
| A、127g I2(g)中通入1gH2(g),反应放出的热量小于4.74kJ |
| B、1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C、反应(ii)的反应物总能量比反应(i)的反应物总能量高 |
| D、反应(i)的产物比反应(ii)的产物稳定 |


 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
| A、定容时观察液面俯视 |
| B、溶质溶解后没有恢复至室温就转移 |
| C、有少量NaOH溶液残留在烧杯中 |
| D、容量瓶中原来有少量蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由于氨极易溶于水,盛有10mL氨气的试管倒立在7mL水中,溶液不会充满试管 |
| B、为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化 |
| C、用酒精灯加热铝箔至熔化,铝并不滴落,说明铝表面生成了一层致密的氧化膜 |
| D、某试液中加入盐酸酸化的硝酸钡溶液,即使出现白色沉淀,也不能判断原试液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、工业上,用焦炭在一定条件下还原二氧化硅得到含杂质的粗硅 |
| B、煤经过气化和液化两个物理变化,可变为清洁能源 |
| C、如将纳米材料分散到液体分散剂中,形成的分散系具有丁达尔效应,由此可推测纳米材料的直径为1~100 nm之间 |
| D、皮革在工业加工时,要使用含铬的鞣制剂,因此往往会造成铬含量的严重超标.重金属铬可使人体内的蛋白质变性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 氯水滴到蓝色石蕊试纸上 | 试纸变红色后又逐渐褪去 | 氯水中有酸性,Cl2有漂白性 |
| B | 浓硝酸滴到蓝色石蕊试纸上 | 试纸变红色后又逐渐褪去 | 浓硝酸具有酸性和强氧化性 |
| C | Fe3O4中加入足量HCl溶液,加热充分反应后,滴入KSCN溶液 | 溶液呈红色 | 盐酸将Fe3O4溶解,得到的是FeCl3溶液 |
| D | 常温下将铜、铁加入浓H2SO4 | 均不溶解 | 常温下铜、铁均不与浓H2SO4反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和乙醇都能发生加聚反应 |
| B、制备乙酸乙酯时,向浓硫酸中缓慢加入乙醇和冰醋酸 |
| C、米酒变酸的过程涉及了氧化反应 |
| D、.K+、MnO4-、CH3CHO和SO42-在酸性条件下大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、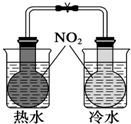 证明温度对平衡移动的影响 |
B、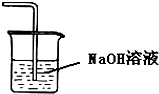 吸收HCl尾气 |
C、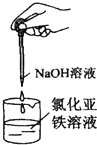 制备氢氧化亚铁 |
D、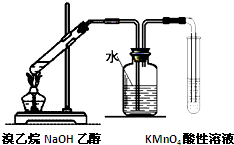 验证溴乙烷消去反应生成了乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①②④ |
| C、②③④ | D、①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com