

| ||
| ||
| ||
| 64 |
| 80 |
| 12.8g |
| 64g/mol |
| 0.8g |
| 16g/mol |


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��127g I2��g����ͨ��1gH2��g������Ӧ�ų�������С��4.74kJ |
| B��1 mol��̬����1 mol��̬���������������17.00 kJ |
| C����Ӧ��ii���ķ�Ӧ���������ȷ�Ӧ��i���ķ�Ӧ���������� |
| D����Ӧ��i���IJ���ȷ�Ӧ��ii���IJ����ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� �ɷ�ֹ�������� |
B�� ϡ��Ũ���� |
C�� ���װ�������� |
D�� ��ȥCO2�е�HCl |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������� |
| B��NaHCO3 |
| C������ |
| D��NaOH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
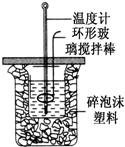 ��50mL 0.50mol?L-1������50mL 0.55mol?L-1 NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ���ⶨǿ����ǿ�Ӧ�ķ�Ӧ�ȣ�
��50mL 0.50mol?L-1������50mL 0.55mol?L-1 NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ���ⶨǿ����ǿ�Ӧ�ķ�Ӧ�ȣ�| ���� ��� | ��ʼ�¶ȣ��棩 | ��ֹ�¶� ���棩 | �¶Ȳ� ���棩 | ||
| ���� | �������� | ƽ��ֵ | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.4 | 24.8 | 24.65 | 27.8 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� |
| �� |
| �� |
| �� |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com