
| A | B | C | D | |
| 装置 | 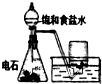 | 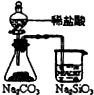 | 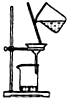 | 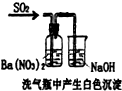 |
| 结论 | 实验室制取乙炔 | 能证明非金属性Cl>C>Si | 分离出Cl2与KI溶液反应生成的碘 | 白色沉淀时BaSO4 |
| A、A | B、B | C、C | D、D、 |


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 过量NH3 |
| Ⅰ |
| 过量CO2 |
| Ⅱ |
溶解度(g) 温度(℃) | NH4Cl | NH4HCO3 | NaHCO3 | NaCl | Na2CO3 | (NH4)2CO3 |
| 20 | 28.7 | 21.7 | 9.6 | 31.5 | 21.5 | 100 |
| 30 | 41.1 | 27.0 | 11.1 | 36.3 | 39.7 | >100 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、HX可能是强酸 |
| B、NaX水溶液的碱性弱于NaY水溶液的碱性 |
| C、HX一定是弱酸 |
| D、反应过程中二者生成H2的速率相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(CH3COO-)>c(Na+) |
| B、c(CH3COOH)>c(CH3COO-) |
| C、2c(H+)=c(CH3COO-)-c(CH3COOH) |
| D、c(CH3COOH)+c(CH3COO-)=0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
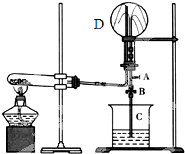 如图为实验室制取NH3且检验其某一性质的实验装置图.完成下列问题;
如图为实验室制取NH3且检验其某一性质的实验装置图.完成下列问题;查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解开始时,阴极有H2放出 |
| B、电解开始时,阳极上发生:Cu2++2e-═Cu |
| C、当电路中通过电子的量超过0.1mol时,阴极放电的种类将发生变化 |
| D、整个电解过程中,SO42-不参加电极反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com