
����Ŀ�����ֶ�����Ԫ��A��B��C��Dԭ���������ε�����ԭ�Ӱ뾶��С�� B��C��D��A������Ԫ��֮�������γɵ�����18���ӽṹ�ķ��ӣ����ǵ����ģ�ͼ������������±���
�� | �� | �� |
|
|
|
��ɫҺ�壬����ǿ�����ԣ������������� | ������ܶ�ԼΪ1.34g/L����Ȼ���еijɷ�֮һ | Һ̬������ǿ��ԭ�ԣ���������ƽ���ȼ�� |
(1)д����ѧʽ����___________����_____________��
(2)Ԫ��B������________��������ͬ�ĵ��ӣ����γɵĵ��ʾ��������__________��
a�����Ӿ��� b�����Ӿ��� c��ԭ�Ӿ��� d����������
(3)��֪1g Һ̬��������Һ̬��Ӧ���ɵ�����ˮ���������ų�20.05kJ��������д����Ӧ���Ȼ�ѧ����ʽ________________��
(4)��ƽ�������ƺ͵������������Һ�ﷴӦ�Ļ�ѧ����ʽ��
____Na2SO3+___KIO3+___H2SO4____Na2SO4+____K2SO4+____I2+ ____H2O��
(5)�÷�Ӧ���̽ϸ��ӣ�һ����Ϊ�����¼�����
��IO3��+SO32��IO2��+SO42������Ӧ����
��IO2��+2SO32��I��+2SO42������Ӧ�죩
��5I��+6H++IO3��3I2+3H2O����Ӧ�죩
��I2+SO32��+H2O2I��+SO42��+2H+����Ӧ�죩
�������������Ʋ⣬�˷�Ӧ������________��������ţ���Ӧ������
(6)��Ԥ�ȼ��������Һ���ɷ�Ӧ���̿�������_______����������ʱ���Ż�����Һ���������������ԭ����_____________________��
���𰸡�H2O2 N2H4 3 bc N2H4��l��+2H2O2��l��=N2��g��+4H2O��g�� ��H=-641.6kJ/mol 5��2��1��5��1��1��1 �� SO32- SO32-�Ļ�ԭ�Դ���I�����ɱ�I2����
��������
���ֶ�����Ԫ��A��B��C��Dԭ���������ε�����ԭ�Ӱ뾶��С��B��C��D��A������Ԫ��֮�������γɵ�����18���ӽṹ�ķ��ӣ����ǵ����ģ�ͼ����������������ΪҺ̬������ǿ�����ԣ������������������ΪH2O2����Ϊ��Ȼ���ijɷ�֮һ���ڱ�����ܶ�ԼΪ1.34g��L-1����Ħ������Ϊ��1.34g��L-1��22.4L/m ol=30g/mol��������ģ�Ϳ�֪��Ϊ���飻��ΪҺ̬������ǿ��ԭ�ԣ���������ƽ���ȼ�ϣ����ΪN2H4������ԭ��������֪��֪��AΪH��BΪC��CΪN��DΪO���ݴ˽��
��1����������������ΪH2O2����ΪN2H4���ʴ�Ϊ��H2O2��N2H4��
��2��Ԫ��BΪC��������6�����ӣ��ֱ�λ��1s��2s��2p����ϣ�����3��������ͬ�ĵ��ӣ�CԪ���γɵĵ��ʾ������Ϊ���Ӿ��塢ԭ�Ӿ��壬��C60�����ʯ���������γ����Ӿ���ͽ������壬�ʴ�Ϊ��3��bc��
��3��1gҺ̬����N2H4��������Һ̬�ף�H2O2����Ӧ����N2��H2O���壬���ų�20.05kJ����������1mol�·�Ӧ�ų�������Ϊ��32��20.05=641.6��kJ���������º������ⷴӦ���Ȼ�ѧ����ʽΪ��N2H4��l��+2H2O2��l��=N2��g��+4H2O��g�� ��H=-641.6kJ/mol���ʴ�Ϊ��N2H4��l��+2H2O2��l��=N2��g��+4H2O��g�� ��H=-641.6kJ/mol��
��4����Ӧ��SԪ�ػ��ϼ���Na2SO3��+4������Ϊ+6�ۣ��ܹ�����2�ۣ�IԪ�ػ��ϼ���KIO3��+5����ΪI2��0�ۣ��ܹ�����10�ۣ����ϼ���С������Ϊ10����Na2SO3ϵ��Ϊ5����I2ϵ��Ϊ1���ٽ��ԭ���غ���ƽ��ʽΪ5Na2SO3+2KIO3+H2SO4��5Na2SO4+K2SO4+I2+H2O���ʴ�Ϊ��5��2��1��5��1��1��1��
��5��������Ӧ����������Ӧ���̵����ʣ��ʷ�Ӧ�����ɢٲ���Ӧ�������ʴ�Ϊ���٣�
��6���ɷ�Ӧ�ܿ�֪��SO32-�Ļ�ԭ�Դ���I�����ɱ�I2����������������SO32-���Ż�����I2���Ż�����Һ����������������ʴ�Ϊ��SO32-��SO32-�Ļ�ԭ�Դ���I�����ɱ�I2������


 ����С��ʿ���������ϵ�д�
����С��ʿ���������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪![]() �����ԭ������Ϊ34.969���������˵����ȷ����( )
�����ԭ������Ϊ34.969���������˵����ȷ����( )
A.��Ԫ�صĽ������ԭ������Ϊ35
B.��Ԫ�ص�ij��ͬλ�ص�������Ϊ35
C.��Ԫ�ص�������Ϊ18
D.��ԭ�ӵ�����Ϊ34.969
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��
��Cu(s)��H2O2(l)��2H��(aq)=Cu2��(aq)��2H2O(l)����H1
��2H2O(l)=2H2(g)��O2(g)����H2
��2H2O2(l)=2H2O(l)��O2(g)����H3
��Cu(s)��2H��(aq)=Cu2��(aq)��H2(g)����H4
����H4����ȷ����ʽΪ(����)
A.��H4����H1��![]() ����H2��
����H2��![]() ����H3B.��H4����H1��
����H3B.��H4����H1��![]() ����H2��
����H2��![]() ����H3
����H3
C.��H4����H1��2����H2��2����H3D.��H4��2����H1����H2����H3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�ֳ���ˮ����������ʳ���������Ѹɣ�����֮�⣬���ѻ���������ơ�
(1)��������֭���������ǵķ����ǣ������мӼ�������ԣ��ټ������Ƶ�Cu(OH)2�����ȣ���������________��
(2)��������ƹ����У�������ת��Ϊ�ƾ��Ĺ������£�����������л�ѧ����ʽ��C6H12O6(������)![]() 2_________+ 2 C2H5OH
2_________+ 2 C2H5OH
(3)���Ѿ��ܷⴢ������л���������ζ�����࣬����Ҳ����ͨ����ѧʵ�����Ʊ���ʵ���ҿ�����ͼ��ʾװ���Ʊ�����������

���Թ�a���������������Ļ�ѧ����ʽ��__________��
���Թ�b��ʢ�ŵ��Լ��DZ���____________��Һ��
��ʵ�鿪ʼʱ���Թ�b�еĵ��ܲ�����Һ���µ�ԭ����________��
����Ҫ������Թ�b�е�������������Ҫ�õ���������_______(����ĸ)��
A.��ͨ©�� B.��Һ©�� C.����©��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͬ�¶Ⱥ�ѹǿ�£��Է�ӦCO2(g)��H2(g)![]() CO(g)��H2O(g)���мס��ҡ�����������ʵ�飬ʵ����ʼʱ���������ڸ���ֵ����ʵ������±�
CO(g)��H2O(g)���мס��ҡ�����������ʵ�飬ʵ����ʼʱ���������ڸ���ֵ����ʵ������±�
| CO2 | H2 | CO | H2O |
�� | amol | amol | 0mol | 0mol |
�� | 2amol | amol | 0mol | 0mol |
�� | 0mol | 0mol | amol | amol |
�� | amol | 0mol | amol | amol |
������������ﵽƽ���n(CO)�Ĵ�С˳����
A. �ң�����������B. �ң������ף���
C. �����ң�������D. ���������ң���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˵�վΪ��ֹ�����˷����¹ʣ�ͨ���ú���Ǧ��ˮ�����������֣��ڳĸְ壬��Ӧ��ѹ������������ͭ�Ⱦ��з�����Ͻ�����Ƴɡ�
(1)ˮ����ͨ������̼�������衢����Ԫ�أ���������Ԫ�صĻ�̬ԭ����3p�ܼ��ϴ��ڵ��ӵ���______(��Ԫ�ط���)
(2)д������ͭ���ӵĻ�̬�����Ų�ʽ��______
(3)Ǧ�ĺ˵����Ϊ82��д��Ǧԭ�ӵļ۵����Ų�ʽ��______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ζ����ɲⶨBa2+�ĺ�����ʵ����������С�
��֪��2CrO42��(��ɫ)+ 2H+ �� Cr2O72��(�Ⱥ�ɫ)+ H2O Ba2+ + CrO42�� �� BaCrO4��
�������ȡx mLһ��Ũ�ȵ�Na2CrO4��Һ����ƿ�У��������ָʾ������b molL��1�����Һ�ζ����յ㣬��õμ��������ΪV0 mL��
�������ȡy mL BaCl2��Һ����ƿ�У�����x mL�벽�����ͬŨ�ȵ�Na2CrO4��Һ����Ba2+��ȫ�������ټ������ָʾ������b molL��1�����Һ�ζ����յ㣬��õμ���������ΪV1mL��BaCl2��Һ��Ũ��Ϊ_________________mol/L����x��y�ı���ʽ����������� �еμ�����ʱ����������Һ������Ba2+Ũ�Ȳ���ֵ��___________���ƫ��ƫС������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������¡��һ�ֶ�������ʧ��֢��ҩ���ϳ�·�����£�
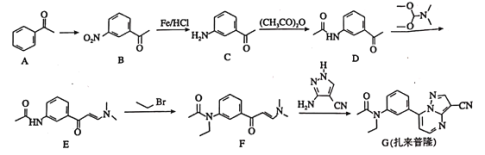
�ش��������⣺
��1��A�еĹ�����������________________��
��2��![]() ������Լ��������ֱ�Ϊ________________��
������Լ��������ֱ�Ϊ________________��
��3��![]() ��
��![]() �ķ�Ӧ��������Ϊ________��________��
�ķ�Ӧ��������Ϊ________��________��
��4��������¡�ķ���ʽΪ________________��
��5��![]() �Ļ�ѧ����ʽΪ________________________��
�Ļ�ѧ����ʽΪ________________________��
��6�����ڷ��㻯����Һ������������ܷ���������Ӧ��B��ͬ���칹����________�֣������������칹�������к˴Ź���������4���Ľṹ��ʽ��________________��
��7����֪��![]() �м������ױ������������
�м������ױ������������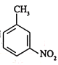 ���Ҵ��Ʊ�
���Ҵ��Ʊ�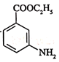 �ĺϳ�·�ߣ����Լ���ѡ����________
�ĺϳ�·�ߣ����Լ���ѡ����________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��ж�Ӧ��ϵ��ȷ����( )
A | CH3CH3+Cl2 CH2=CH2+HCl��CH3CH2Cl | ��Ϊȡ����Ӧ |
B | ����֬�õ����ͣ���±�����ƴ� | ��������ˮ�ⷴӦ |
C | Cl2+2Br��2Cl+Br2��Zn+Cu2+��Zn2++Cu | ��Ϊ���ʱ���ԭ���û���Ӧ |
D | 2Na2O2+2H2O��4NaOH+O2���� 2F2+2H2O��4HF+ O2 | ��Ϊˮ����ԭ����������ԭ��Ӧ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com