
【题目】(1)实验室制取氯气时,下列操作不正确的是________(填字母)。


A.装置Ⅰ可用于制取少量氯气
B.用装置Ⅱ除去氯气中的少量氯化氢
C.用装置Ⅲ制取氯气
D.用装置Ⅳ干燥氯气
(2)实验室制取干燥、纯净的氯气,除了二氧化锰、浓盐酸外还需要的试剂____、_____、______。
(3)已知高锰酸钾与浓盐酸在常温下反应能产生氯气。若用如下图所示的实验装置来制备纯净、干燥的氯气及验证它与金属的反应。每个虚线框表示一个单元装置,其中有错误的是________(填字母)。

(4)氯气是有毒气体,必须进行尾气处理,写出实验室氯气尾气处理的离子方程式___________。
(5)漂白液(次氯酸钠)和洁厕灵(盐酸)不能混合使用会产生氯气有毒气体的离子方程式:____。
【答案】ABCD 饱和食盐水 浓H2SO4 氢氧化钠溶液 BD Cl2+2OH-=Cl-+ClO-+H2O Cl-+ClO-+2H+=Cl2↑+H2O
【解析】
(1)实验室利用浓盐酸和二氧化锰混合加热制备氯气,根据实验原理和氯气的性质分析判断;
(2)根据氯气中混有的杂质气体以及氯气需要尾气处理分析解答;
(3)KMnO4与浓HCl在常温下反应产生Cl2,浓盐酸易挥发,从发生装置生成的氯气中含有挥发的HCl和水蒸气杂质,结合实验装置图分析解答;
(4)一般用氢氧化钠溶液吸收氯气,据此解答;
(5)次氯酸钠能氧化盐酸生成氯气,据此解答。
(1)A.实验室利用浓盐酸和二氧化锰混合加热制备氯气,装置Ⅰ的盐酸是稀盐酸,不能用于制取少量氯气,A错误;
B.氯气也能与碳酸氢钠反应,应该用饱和食盐水除去氯气中的少量氯化氢,且应该是长口进短口出,B错误;
C.实验室利用浓盐酸和二氧化锰混合加热制备氯气,装置Ⅲ中缺少加热装置,不能制取氯气,C错误;
D.用装置Ⅳ干燥氯气时应该是长口进短口出,D错误;
答案选ABCD;
(2)实验室制取干燥、纯净的氯气,由于生成的氯气中含有水蒸气和氯化氢,且氯气有毒需要尾气处理,则除了二氧化锰、浓盐酸外还需要的试剂有除去氯化氢的饱和食盐水,干燥氯气的浓硫酸以及吸收尾气的氢氧化钠溶液;
(3)KMnO4与浓HCl在常温下反应产生Cl2,故A装置正确;浓盐酸易挥发,从发生装置生成的氯气中含有挥发的HCl和水蒸气杂质,应通入盛有饱和食盐水的洗气瓶除去HCl,不用选择氢氧化钠溶液,故B装置错误;用浓硫酸干燥氯气,导管应长进短出,故C装置正确;氯气与金属在试管中反应若用单孔塞,容易造成试管内压强过大,且导管应插入试管底部,故D装置错误;答案选BD;
(4)氯气是有毒气体,必须进行尾气处理,实验室氯气尾气处理一般用氢氧化钠溶液,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O。
(5)次氯酸钠具有强氧化性,能氧化盐酸产生氯气有毒气体,反应的离子方程式为Cl-+ClO-+2H+=Cl2↑+H2O。


科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。
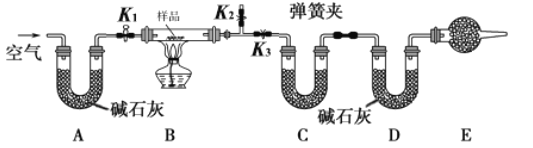
(1)请将实验步骤补充完整
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是 _____________________。
②称取样品,并将其放入硬质玻璃管中;并称量C、D装置的质量。
③打开活塞K1和K2,关闭K3,缓慢鼓入空气数分钟,其目的是____________________。
④关闭活塞K1和K2,打开K3,点燃酒精灯加热至不再产生气体。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后卸下装置,再次称量C、D装置的质量。
(2)关于该实验方案,请回答下列问题:
①若加热反应后不鼓入空气,对NaCl测定结果的影响是___________(“偏高”、“偏低”或“无影响”)
②E处干燥管中盛放的药品是_______________,其作用是_____________________________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量分数______________(“偏高”、“偏低”或“无影响”)
③若样品质量为wg,反应后C、D装置增加的质量分别为m1g和m2g,由此可知混合物中Na2CO3·10H2O的质量分数为______(用含w、m1、m2的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如下装置制取氯气,并用氯气进行实验。回答下列问题:

(1)A中盛有浓盐酸,B中盛有MnO2,写出反应的化学方程式_____________。
(2)D中放入浓H2SO4,其目的是_____________________________。
(3)E中为红色干布条,F中为红色湿布条,可观察到的现象是___________,对比E和F中现象的差异可得出的结论及解释是________________________________。
(4)G处的现象是____________________________________。
(5)画出H处尾气吸收装置图并注明试剂____________。
(6)家庭中常用消毒液(主要成分NaClO)与洁厕灵(主要成分盐酸)清洁卫生。某品牌消毒液包装上说明如下图。

①“与洁厕灵同时使用”会产生有毒的氯气,写出反应的离子方程式__________。
②需“密闭保存”的原因____________________________________________。
(7)现在有一种名为“净水丸”的产品也能对饮用水进行快速的杀菌消毒,药丸通常分内外两层。外层的优氯净Cl2Na(NCO)3先与水反应,生成次氯酸起杀菌消毒作用;几分钟后,内层的亚硫酸钠(Na2SO3)溶出,可将水中的余氯(次氯酸等)除去。亚硫酸钠将水中多余次氯酸除去的离子反应方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,从A处通入纯净的Cl2,打开B阀时,C处的红色布条上看不到明显现象;当关闭B阀后,C处红布逐渐褪色,则D瓶中装的是( )

A. 浓H2SO4 B. NaOH溶液 C. Na2SO3溶液 D. 饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W、M 均为短周期元素。25℃时,其最高价氧化物对应的水化物(浓度均为0.01mol/L)溶液的pH和原子半径的关系如图所示。下列说法不正确的是

A. X、M 简单离子半径大小顺序:X>M
B. X、Y、Z、W、M 五种元素中只有一种是金属元素
C. Z 的最高价氧化物的化学式为ZO3
D. X、Z的最简单气态氢化物反应现象:有白烟生成XY ZW
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的一组是( )
①.制取漂白液的反应原理: Cl2+2OH-=== Cl-+ClO-+ H2O
②.铁粉加入到三氯化铁溶液中: Fe3+ +Fe === 2Fe2+
③.NaHCO3溶液中加入稀盐酸:CO32-+2H+![]() CO2↑+H2O
CO2↑+H2O
④.向澄清石灰水中加入少量小苏打溶液: Ca2++OH-+HCO3-=== CaCO3↓+H2O
⑤.硫酸铝溶液与足量的氨水混合反应: Al3+ + 4OH- === AlO2-+ H2O
⑥.过量氯水与FeCl2溶液作用: 2Fe2++Cl2 ==2 Fe3++2Cl-
A. ①②③ B. ③⑥ C. ①③⑥ D. ①④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含镍(Ni)废催化剂中主要含有Ni,还含有Al、Al2O3、Fe及其它不溶于酸、碱的杂质。部分金属氢氧化物Ksp近似值如下表所示:如下:
化学式 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 |
Ksp近似值 | 10-17 | 10-39 | 10-34 | 10-15 |
现用含镍废催化剂制备NiSO4·7H2O晶体,其流程图如下:

回答下列问题:
(1)“碱浸”时发生反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,________________。
(2)“酸浸”所使用的酸为_____________。
(3)“净化除杂”需加入H2O2溶液,其作用是__________________________。然后调节pH使溶液中铁元素恰好完全沉淀,列式计算此时的pH。___________________________
(4)“操作A”为_____、过滤、洗涤、干燥,即得产品。
(5)NiSO4在强碱性溶液中可被NaClO氧化为NiOOH,该反应的离子方程式为__________________。
(6)NiOOH可作为镍氢电池的电极材料,该电池的工作原理如下图所示,其放电时,正极的电极反应式为__________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组利用如图装置进行铁与水蒸气反应的实验,并检验产物的性质,请回答下列问题:

(1)A装置的作用是____________,烧瓶底部放碎瓷片的作用是_____________。
(2)装置B中发生反应的化学方程式是___________,该反应中氧化剂是__________,氧化产物是_____________。
(3)D的作用是__________。
(4)E中的实验现象是_______________。
(5)A、B两个装置中应先点燃____处的酒精(喷)灯,点燃E处酒精灯之前应进行的操作是_______。
(6)该同学对反应后硬质试管中固体物质的组成提出了如下假设:
假设1:只有Fe;
假设2:只有________;
假设3:既有Fe也有Fe3O4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天宫二号空间实验室已于2016 年9月15日22时04分在酒泉卫星发射中心发射成功。请回答下列问题:

(1)耐辐照石英玻璃是航天器姿态控制系统的核心元件。石英玻璃的成分是______(填化学式)
(2)“碳纤维复合材料制品”应用于“天宫二号”的推进系统。碳纤维复合材料具有重量轻、可设计强度高的特点。碳纤维复合材料由碳纤维和合成树脂组成,其中合成树脂是高分子化合物,则制备合成树脂的反应类型是_____________。
(3)太阳能电池帆板是“天宫二号”空间运行的动力源泉,其性能直接影响到“天宫二号”的运行寿命和可靠性。
① 天宫二号使用的光伏太阳能电池,该电池的核心材料是_____,其能量转化方式为_____。
② 下图是一种全天候太阳能电池的工作原理:

太阳照射时的总反应为V3++ VO2++ H2O=V2++VO2++2H+,则负极反应式为__________;夜间时,电池正极为______(填“a”或“b”)。
(4)太阳能、风能发电逐渐得到广泛应用,下列说法中,正确的是______(填字母序号)。
a.太阳能、风能都是清洁能源
b.太阳能电池组实现了太阳能到电能的转化
c.控制系统能够控制储能系统是充电还是放电
d.阳光或风力充足时,储能系统实现由化学能到电能的转化
(5)含钒废水会造成水体污染,对含钒废水(除VO2+外,还含有Al3+,Fe3+等)进行综合处理可实现钒资源的回收利用,流程如下:

已知溶液pH范围不同时,钒的存在形式如下表所示:
钒的化合价 | pH<2 | pH>11 |
+4价 | VO2+,VO(OH)+ | VO(OH)3- |
+5价 | VO2+ | VO43- |
①加入NaOH调节溶液pH至13时,沉淀1达最大量,并由灰白色转变为红褐色,用化学用语表示加入NaOH后生成沉淀1的反应过程为_______、_______;所得滤液1中,铝元素的存在形式为__________。
②向碱性的滤液1 (V的化合价为+4)中加入H2O2的作用是________(用离子方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com