
利用I2O5可消除CO污染或定量测定CO,反应为:5CO(g)+I2O5(s) 5CO2(g)+I2(s);ΔH 1
5CO2(g)+I2(s);ΔH 1
(1)已知:2CO(g)+O2(g) 2CO2(g);ΔH 2
2CO2(g);ΔH 2
2I2(s)+5O2(g) 2I2O5(s);ΔH 3
2I2O5(s);ΔH 3
则ΔH 1= (用含ΔH 2和ΔH 3的代数式表示)。
(2)不同温度下,向装有足量I2O5固体的2 L恒容密闭容器中通入2molCO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图。请回答:
①从反应开始至a点时的反应速率为v(CO)= ,b点时化学平衡常数Kb= 。
②d点时,温度不变,若将容器体积压缩至原来的一半,请在图中补充画出CO2体积分数的变化曲线。
③下列说法正确的是 。(填字母序号)
| A.容器内气体密度不变,表明反应达到平衡状态 |
| B.两种温度下,c点时体系中混合气体的平均相对分子质量相等 |
| C.增加I2O5的投料量有利于提高CO的转化率 |
| D.b点和d点的化学平衡常数:Kb<Kd |
(1)2.5ΔH2-0.5ΔH3(3分)
(2)①0.6mol·L-1·min-1(2分,不带单位扣1分),1024 或者45(3分)
②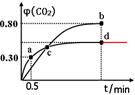
③AB(2分,选对一个得1分,有错选得0分)
(3)8.96%(3分,三位有效数字,错误扣1分)
解析试题分析:(1)根据盖斯定律,对照第1个反应和第2个反应中CO,对照第1个反应和第3个反应中I2或I2O5,可得ΔH 1=2.5ΔH2-0.5ΔH3。
(2)①设转化的CO物质的量浓度为x,根据三段式进行计算:
5CO(g)+I2O5(s) 5CO2(g)+I2(s)
5CO2(g)+I2(s)
起始浓度(mol?L?1) 1 0
转化浓度(mol?L?1) x x
平衡浓度(mol?L?1) 1-x x
a点CO2的体积分数为0.3,则x/1=0.3,可得x=0.3mol?L?1,则v(CO)=0.3mol/L÷0.5min = 0.6mol·L-1·min-1;类似a点计算,可求出b点CO的平衡浓度为0.2mol?L?1,CO2的 平衡浓度为0.8mol?L?1,则b点时化学平衡常数Kb=c5(CO2)÷c5(CO)=0.85÷0.25=45。
②d点时,温度不变,若将容器体积压缩至原来的一半,压强增大,因为该反应前后气体的系数相等,所以增大压强,平衡不移动,CO2的体积分数不变,可画出CO2体积分数的变化曲线。
③A、容器内气体密度不变,说明气体的质量不变,则反应达到平衡状态,正确;B、c点时两温度下CO2的体积分数相等,说明气体组成相同,则体系中混合气体的平均相对分子质量相等,正确;C、因为I2O5为固体,增加I2O5的投料量,CO的转化率不变,错误;D、b点CO2的体积分数大,说明b点平衡常数大,所以Kb > Kd,错误。
(3)根据化学方程式可得对应关系:5CO ~ I2~2Na2S2O3,n(CO)=5/2n(Na2S2O3)=5/2×0.0100mol·L-1×0.02L×4=0.002mol,则样品气中CO的体积分数为:0.002mol×22.4L/mol÷0.5L×100%=8.96%
考点:本题考查盖斯定律、化学反应速率的计算、化学平衡的判断和计算、体积分数的计算。


科目:高中化学 来源: 题型:单选题
氨氧化制硝酸的反应如下(未配平):①NH3 + O2 →NO + H2O ②NO + O2 → NO2
③NO2+H2O→HNO3+NO,如将氨全部氧化得2mol硝酸,理论上需氧气的物质的量是( )
| A.2mol | B.3 mol | C.4 mol | D.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
Cu+2H2SO4(浓)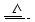 CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于 (用字母代号填写)
A.酸 B.碱 C.盐 D.酸性氧化物 E.碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中 (填写化学式,下同)失去电子,氧化剂是 。
(2)若A物质通入品红溶液,观察到溶液褪色,说明A物质具有 (填序号,下同);若A物质通入Na2S溶液,观察到溶液中出现淡黄色浑浊,说明SO2具有 。
A.氧化性 B.还原性 C.漂白性
若A物质通入双氧水,请大胆判断所得溶液是 (填溶质的化学式)
(3)一定量的铜片与100mL 18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的A气体在标准状况下体积为 L (假设气体全部逸出)。若用4 mol·L-1的NaOH溶液吸收生成的A,并生成正盐,写出发生的反应方程式 计算需要NaOH溶液的体积 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
请将5种物质:N2O、FeCl2、Fe(NO3)3、HNO3和FeCl3分别填入下面对应的横线上,组成一个未配平的化学方程式。
(1) + → + + +H2O(不需配平)
(2)反应过程中,N2O与FeCl2的物质的量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化钙晶体[CaO2·8H2O]较稳定,呈白色,微溶于水,能溶于酸性溶液。广泛应用于环境杀菌、消毒等领域。
★过氧化钙晶体的制备
工业上生产CaO2·8H2O的主要流程如下: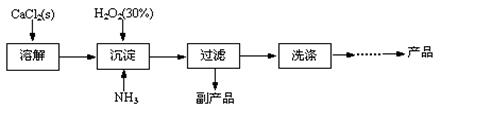
(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在10℃以下和通入过量的NH3,其可能原因分别是
① ;② 。
★过氧化钙晶体含量的测定
准确称取0.3000g产品于锥形瓶中,加入30 mL蒸馏水和10 mL 2.000 mol·L-1 H2SO4,用0.0200mol·L—1 KMnO4标准溶液滴定至终点。重复上述操作两次。H2O2和KMnO4反应的离子方程式为2MnO4-+5 H2O2+6H+=2Mn2++5O2↑+8H2O
(3)滴定终点观察到的现象为 。
(4)根据表1数据计算产品中CaO2·8H2O的质量分数(写出计算过程):
| 滴定次数 | 样品的质量/g | KMnO4溶液的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 24.04 |
| 2 | 0.3000 | 2.00 | 25.03 |
| 3 | 0.3000 | 0.20 | 23.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
近年来地质、环境灾难频频发生,为防止在大灾之后疫病流行,灾区需要大量的各种消毒剂、漂白剂等。
(1)二氧化氯是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3与SO2在H2SO4作用下反应制得。请写出反应的离子方程式: 。
(2)过碳酸钠是一种新型固态漂白剂,化学式可表示为Na2CO3·3H2O2,它具有Na2CO3和H2O2的双重性质。过碳酸钠与下列物质均会发生化学反应而失效,其中过碳酸钠只发生了氧化反应的是 。
| A.MnO2 | B.KMnO4溶液 | C.稀盐酸 | D.Na2SO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成成分,是人体中含量最多的一种物质。而“四种基本反应类型
与氧化还原反应的关系”也可用如图表达。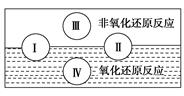
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:________________________,其中水为________剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:
CuO+____NH4Cl Cu+____CuCl2+N2↑+____H2O。
Cu+____CuCl2+N2↑+____H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是________(填元素名称),氧化剂是________(填化学式)。
(3)(2011·福建高考卷节选)磷酸钙与焦炭、石英砂混合,在电炉中加热到1 500 ℃生成白磷,反应为:
2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10,10C+P4O10=P4+10CO。
每生成1 mol P4时,就有________mol电子发生转移。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
将5.5 g铁铝混合物粉末加入900mL 1.00 mol/L HNO3溶液中,充分反应后,得a L(标准状况)NO气体。
(1)HNO3是否过量___________。
(2)若a=3.36L(标准状况),则混合物中铝的质量分数为_________%。
(3)若a=3.36L(标准状况),往反应后的溶液中加入___________ mL 1.000 mol/L NaOH溶液时生成的沉淀量最大,还要加________ mL 1.000 mol/L NaOH溶液才能使沉淀的量保持不变。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
环境中常见的重金属污染物有:汞、铅、锰、铬、镉。处理工业废水中含有的Cr2O72-和CrO42-,常用的方法有两种。
方法1 还原沉淀法
该法的工艺流程为 。
。
其中第①步存在平衡2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O。
Cr2O72-(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式_________________________________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol Cr2O72-,需要________mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):____________________________________________________________________________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):____________________________________________________________________________。
方法2 电解法
(5)实验室利用如图装置模拟电解法处理含Cr2O72-的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是___________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com