
【题目】下列说法正确的是( )
A.![]() 与
与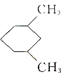 的一氯代物数目相同(不考虑立体异构)
的一氯代物数目相同(不考虑立体异构)
B.石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化
C.淀粉溶液中加入稀硫酸,加热4-5min,再加入少量银氨溶液,加热,有光亮银镜生成
D.福尔马林能使蛋白质发生变性,可用于浸制动物标本
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】工业上用铝土矿![]() 主要成分
主要成分![]() ,含
,含![]() 、
、![]() 等杂质
等杂质![]() 冶炼铝的主要流程如图:
冶炼铝的主要流程如图:

![]() 注:
注:![]() 碱溶时转变为铝硅酸钠沉淀
碱溶时转变为铝硅酸钠沉淀![]()
下列叙述错误的是( )
A.操作I增大NaOH溶液用量可提高![]() 的浸取率
的浸取率
B.操作Ⅱ、Ⅲ为过滤,操作Ⅳ为灼烧
C.通入过量![]() 的离子方程式为
的离子方程式为![]()
D.加入的冰晶石目的是降低![]() 的熔融温度
的熔融温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取自来水的装置示意图,根据图示回答下列问题。

(1)图中的两处明显的错误是____________________、_____________________。
(2)A仪器的名称是______________,B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,还需加入少量___________,其作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的结构决定性质。回答下列有关问题:
(1)BF3的空间构型为______。SO32-中心原子的杂化类型是______。
(2)H2S的沸点比H2O2的沸点______![]() 选填“高”或“低”
选填“高”或“低”![]() ;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
(3)从分子结构的角度分析“白磷不溶于水,易溶于CS2”的原因______。
(4)CuCl难溶于水但易溶于氨水,其原因是______;此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______。
(5)已知CaF2晶胞结构如图所示,晶体密度为![]() g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含
g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含![]() 、NA的代数式表达)
、NA的代数式表达)
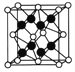
(6)一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,该晶体中原子之间的作用力是______;该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼镁矿属于硼酸盐,可用来制备硼酸(H3BO3)和MgO,方法如下:硼镁矿粉与(NH4)2SO4溶液混合后加热,反应生成H3BO3晶体和MgSO4溶液,同时放出NH3;再向MgSO4溶液中通入NH3与CO2,得到MgCO3沉淀和滤液,沉淀经洗涤、煅烧后得MgO,滤液则循环使用。回答下列问题:
(1)与硅酸盐类似,硼酸盐结构也比较复杂,如硬硼钙石化学式为Ca2B6O11·5H2O,将其改写为氧化物的形式_____________________________。
(2)上述制备过程中,检验沉淀洗涤是否完全的方法是_______________________。
(3)写出MgSO4溶液中通入NH3与CO2反应的化学方程式_______________________。
(4)若准确称取1.68 g硼镁矿,完全反应后得H3BO3晶体1.24 g,MgO 0.8 g,计算该硼酸盐的组成。(写出计算过程)___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁触媒是重要的催化剂,CO易与铁触媒作用导致其失去催化活性:Fe+5CO=Fe(CO)5;除去CO的化学反应为:[Cu(NH3)2]OOCCH3+CO+NH3=[Cu(NH3)3(CO)]OOCCH3,
(1)Fe(CO)5又名羰基铁,常温下为黄色油状液体,则Fe(CO)5的晶体类型是_____,与CO互为等电子体的分子的电子式为______________。
(2)硝酸钾中NO3-的空间构型_____,与NO3-互为等电子体的一种非极性分子化学式为_____。
(3)配合物[Cu(NH3)2]OOCCH3中碳原子的杂化类型是________,配位体中提供孤对电子的原子是________。
(4)用[Cu(NH3)2]OOCCH3除去CO的反应中,肯定有______形成.
a.离子键 b.配位键 c.非极性键 d.σ键
(5)铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示,

写出该反应的化学方程式____________________。 若两个最近的Fe原子间的距离为s cm,则该晶体的密度是__________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中_____(填“s”、“p”、“d”或“ds”)区。[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是_____。
(2)表中是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1mol该配离子中含σ键数目为______。
②该配合物中存在的作用力类型有______(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO的熔点(1660℃)比MnS的熔点(1610℃)高,其主要原因是________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。

①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于_______位置,X处于______位置(限选“体心”、“顶点”、“面心”或“棱心”进行填空)。
③CH3NH3PbI3晶体的晶胞参数为a nm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入NO2气体,发生反应2NO2(g)![]() N2O4(g):
N2O4(g):
(1)恒温恒压时,平衡后充入惰性气体,平衡___移动(填“正向”、“逆向”或“不”);
(2)平衡后慢慢压缩气体体积,平衡向右移动,混合气体颜色___(填“加深”、“变浅”或“不变”);
(3)若向体积为2L的恒容密闭容器中充入2molNO2,达到平衡状态时NO2转化率为a,向体积为2L的恒压密闭容器中充入2molNO2,达到平衡状态时NO2转化率为b,则a__b(填“>”、“<”或“=”);
(4)若向体积为2L的恒容密闭容器中充入2molNO2,达到平衡状态时NO2体积分数为a,再向该容器中继续充入1molN2O4,达到新平衡后NO2体积分数为b,则a__b(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.实验室将少量Na保存在乙醇中
B.可用激光笔鉴别FeCl3溶液和Fe(OH)3胶体
C.32 g O3中含有的氧原子数约是3×6.02×1023
D.常温下,可以用铝制容器来储运浓盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com