
【题目】工业上用铝土矿![]() 主要成分
主要成分![]() ,含
,含![]() 、
、![]() 等杂质
等杂质![]() 冶炼铝的主要流程如图:
冶炼铝的主要流程如图:

![]() 注:
注:![]() 碱溶时转变为铝硅酸钠沉淀
碱溶时转变为铝硅酸钠沉淀![]()
下列叙述错误的是( )
A.操作I增大NaOH溶液用量可提高![]() 的浸取率
的浸取率
B.操作Ⅱ、Ⅲ为过滤,操作Ⅳ为灼烧
C.通入过量![]() 的离子方程式为
的离子方程式为![]()
D.加入的冰晶石目的是降低![]() 的熔融温度
的熔融温度
【答案】C
【解析】
Al2O3、Fe2O3和硫酸反应,选择氢氧化钠,将氧化铝和Fe2O3分离出来,将氧化铝溶解为偏铝酸钠,固体难溶物是氧化铁和铝硅酸钠沉淀,滤液为偏铝酸钠,通二氧化碳来获得氢氧化铝沉淀,发生CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,氢氧化铝加热分解生成氧化铝,电解可得铝,以此解答该题。
A. 增大NaOH溶液用量,可使氧化铝完全反应,提高氧化铝的浸取率,故A正确;
B. 操作Ⅱ、Ⅲ用于分离固体和液体,为过滤操作,操作Ⅳ可使氢氧化铝转化为氧化铝,则为灼烧,故B正确;
C. 通入过量![]() 的离子方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,生成碳酸氢钠,故C错误;
的离子方程式为CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-,生成碳酸氢钠,故C错误;
D. 氧化铝熔点较高,加入冰晶石,可降低熔点,利于熔化,故D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】化学实验是学习理解化学知识的基础,它以其魅力和丰富的内涵在化学学习中发挥着独特的功能和作用。请回答下列问题:
实验室欲配制100mL1mol·L-1的Na2CO3溶液。
(1)配制上述溶液,下列没有用到的仪器是__(填标号)。
A.烧杯 B.大试管 C.胶头滴管 D.100mL容量瓶
(2)除上述仪器外,还一定用到的玻璃仪器是__。
(3)从下表中选择称量Na2CO3·10H2O固体所需要的仪器有__(填标号)。
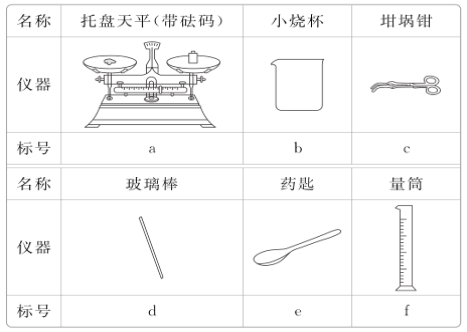
(4)下列情况使所配溶液的浓度如何变化?
①未洗涤溶解Na2CO3·10H2O的烧杯__(填“偏大”“偏小”或“不变”,后同)。
②容量瓶使用前用蒸馏水洗过,内壁附有水珠__。
③定容时加蒸馏水超过了刻度线,将多出的液体吸出__。
④定容时俯视容量瓶刻度线__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烷烃和气态单烯烃组成的混合气体,其密度是同条件下H2密度的13倍,把标准状况下2.24 L,该混合体通入足量的溴水中,溴水增重1.4 g。
(1)该混合烃的平均摩尔质量为________;其中一定含有________(写名称)。
(2)通过简计算,确定另一种烃的分子组成:_________。
(3)写出该混合烃中单烯烃所有可能的异构体(考虑顺反异构)任意写两种________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如右图,关闭活塞K,向A中充入1 molX、1 molY,向B中充入2 molX、2molY, 此时A、B的容积都是a L。在相同温度和催化剂存在的条件下,使两容器中各自发生下述反应:X(g)+Y(g)![]() 2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是
2Z(g)+W(g);△H<0。A保持恒压,B保持恒容,达平衡时,A的体积为1.4a L。下列说法正确的是
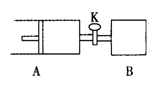
A.反应速率:v(B)<v(A)
B.平衡时Y的体积分数:A>B
C.打开K后达平衡时A的体积为2.4a L
D.A容器中X的转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示。下列叙述正确的是( )
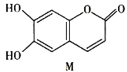
A.常温下,能与Na2CO3溶液反应放出CO2
B.1mol M最多能与2mol Br2发生反应
C.M与足量的NaOH溶液反应时,所得有机产物的化学式为C9H4O5Na4
D.该有机物不能使FeCl3溶液显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮族元素包括N、P、As、Sb和Bi五种元素。
(1)下列关于氮族元素的说法正确的是___。
a.N2可用于填充霓虹灯。其发光原理是电子从能量较低的轨道跃迁到能量较高的轨道,以光的形式释放能量
b.P、Na、S三种元素的第一电离能由大到小的顺序是:P>S>Na
c.基态As原子中,电子占据的最高能级为4d
d.Bi原子中最外层有5个能量相同的电子
(2)NH3在水中的溶解度比PH3大得多,其原因是___![]() 向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有___和___。
向硫酸铜溶液中加入过量氨水,然后加入适量乙醇,溶液中析出深蓝色的[Cu(NH3)4]SO4晶体。该晶体中含有的化学键除普通的共价键外,还有___和___。
(3)PCl3分子中,Cl-P-Cl键的键角___109°28'(填“>”“<”或“2”![]() 。
。
(4)白磷(P4)是磷的一种单质,它属于分子晶体,其晶胞结构如图。已知该晶体的密度为ρg·cm-3,晶胞的边长为acm,则阿伏加德罗常数为___mol-1(用含p、a的式子表示![]() 。
。
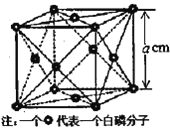
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究![]() 、NO、
、NO、![]() 、CO等大气污染气体的处理具有重要意义。
、CO等大气污染气体的处理具有重要意义。
(1)已知:CO可将部分氮的氧化物还原为![]() 。
。
反应I:![]()
反应II:![]()
则反应![]() 的
的![]() =___________kJ·mol-1。
=___________kJ·mol-1。
(2)一定条件下,将![]() 与CO以体积比1∶2置于恒容密闭容器中发生反应II,下列能说明反应达到平衡状态的是________________。
与CO以体积比1∶2置于恒容密闭容器中发生反应II,下列能说明反应达到平衡状态的是________________。
a. 体系压强保持不变 b. 容器中气体密度保持不变
c. 混合气体颜色保持不变d. 每消耗![]() 的同时生成
的同时生成![]()
(3)温度为T 容积为10L的恒容密闭容器中,充入1molCO和0.5mol![]() 发生反应:
发生反应:
![]() 实验测得生成的
实验测得生成的![]() 体积分数
体积分数![]() 随着时间的变化曲线如图1所示:
随着时间的变化曲线如图1所示:
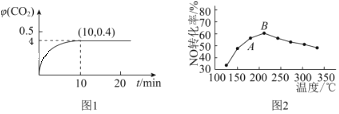
①达到平衡状态时,![]() 的转化率为______,该温度下反应的平衡常数
的转化率为______,该温度下反应的平衡常数![]() _________。
_________。
②其它条件保持不变,再向上述平衡体系中充入![]() 、
、![]() 、
、![]() 、
、![]() 各
各![]() ,此时V(正)__________ V(逆)填“﹥”“ <”或“=”。
,此时V(正)__________ V(逆)填“﹥”“ <”或“=”。
4)![]() 法是工业上消除氮氧化物的常用方法,反应原理为
法是工业上消除氮氧化物的常用方法,反应原理为![]() ,在催化剂作用下,NO转化率与温度的关系如图2所示:图中A点处NO的转化率____________填“可能是”、“一定是”或“一定不是”该温度下的平衡转化率;B点之后,NO转化率降低的原因可能是______。
,在催化剂作用下,NO转化率与温度的关系如图2所示:图中A点处NO的转化率____________填“可能是”、“一定是”或“一定不是”该温度下的平衡转化率;B点之后,NO转化率降低的原因可能是______。
A. 平衡常数变大 B. 副反应增多
C. 催化剂活性降低 D. 反应活化能增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.![]() 与
与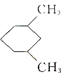 的一氯代物数目相同(不考虑立体异构)
的一氯代物数目相同(不考虑立体异构)
B.石油的裂化、煤的气化与液化都属于化学变化,而石油的分馏与煤的干馏都属于物理变化
C.淀粉溶液中加入稀硫酸,加热4-5min,再加入少量银氨溶液,加热,有光亮银镜生成
D.福尔马林能使蛋白质发生变性,可用于浸制动物标本
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com