
【题目】某气态烷烃和气态单烯烃组成的混合气体,其密度是同条件下H2密度的13倍,把标准状况下2.24 L,该混合体通入足量的溴水中,溴水增重1.4 g。
(1)该混合烃的平均摩尔质量为________;其中一定含有________(写名称)。
(2)通过简计算,确定另一种烃的分子组成:_________。
(3)写出该混合烃中单烯烃所有可能的异构体(考虑顺反异构)任意写两种________。
【答案】26 g/mol 甲烷 C4H8 CH2=CH—CH2CH3、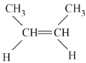 、
、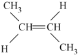 、
、![]() 中任意两种
中任意两种
【解析】
M(混合)=13×2 g/mol=26 g/mol,烯烃的摩尔质量最小为28 g/mol,则烷烃的摩尔质量应小于26 g/mol,摩尔质量小于26 g/mol的只有CH4,所以混合气体中一定含有甲烷,溴水增重1.4 g为烯烃的质量,可计算出甲烷的质量,进而计算烯烃的物质的量,再计算烯烃的摩尔质量,结合烯烃的组成通式确定烯烃分子式,由单烯烃的同分异构体可能有碳链异构、位置异构、顺反异构分析判断。
(1) M(混合)=13×2 g/mol=26 g/mol,烯烃的摩尔质量最小为28 g/mol,则烷烃的摩尔质量应小于26 g/mol,由于烷烃摩尔质量最小的是甲烷,为16 g/mol,乙烷为30 g/mol,所以混合气体中一定含有甲烷;
(2)2.24 L标准状况下的混合气体的物质的量n(混合)=![]() =0.1 mol,混合气体质量为m(混)=0.1 mol×26 g/mol=2.6 g,在烷烃与烯烃混合物中只有烯烃能够与溴水发生反应,溴水增重1.4 g为烯烃的质量,则甲烷的质量m(CH4)=2.6 g-1.4 g=1.2 g,甲烷的物质的量n(CH4)=
=0.1 mol,混合气体质量为m(混)=0.1 mol×26 g/mol=2.6 g,在烷烃与烯烃混合物中只有烯烃能够与溴水发生反应,溴水增重1.4 g为烯烃的质量,则甲烷的质量m(CH4)=2.6 g-1.4 g=1.2 g,甲烷的物质的量n(CH4)=![]() =0.075 mol,则烯烃的物质的量为n(烯烃)=0.1 mol-0.075 mol=0.025 mol,设烯烃的化学式为CnH2n,则烯烃的摩尔质量M(CnH2n)=
=0.075 mol,则烯烃的物质的量为n(烯烃)=0.1 mol-0.075 mol=0.025 mol,设烯烃的化学式为CnH2n,则烯烃的摩尔质量M(CnH2n)=![]() =56 g/mol,12n+2n=56,解得n=4,故该烯烃分子式为C4H8;
=56 g/mol,12n+2n=56,解得n=4,故该烯烃分子式为C4H8;
(4)分子式为C4H8的单烯烃为丁烯,有4种烯烃的同分异构体,分别是1-丁烯、2-丁烯(顺反两种结构)、2-甲基-1-丁烯,它们的结构简式分别为:CH2=CH—CH2CH3、 、
、 、
、![]() 。
。


科目:高中化学 来源: 题型:
【题目】已知热化学方程式SO2(g)+1/2O2(g)![]() SO3(g) △H=-98.32kJ·mol-1,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量
SO3(g) △H=-98.32kJ·mol-1,在容器中充入2mol SO2和1mol O2充分反应,最终放出的热量
A. 等于196.64kJ B. 等于196.64kJ·mol-1
C. 小于196.64kJ D. 大于196.64kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜。请按要求回答相关问题:

(1)石墨电极(C)作___极,丙池中滴有酚酞,实验开始后观察到的现象是_____,甲中甲烷燃料电池的负极反应式为________。
(2)若消耗2.24 L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为___ L。
(3)丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______。
A.b电极为粗铜
B.粗铜接电源正极,发生还原反应
C.CuSO4溶液的浓度保持不变
D.利用阳极泥可回收Ag、Pt、Au等金属
(4)若丙中以稀H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为__________。
(5)假设乙装置中氯化钠溶液足够多,若在标准状况下,有224 mL氧气参加反应,则乙装置中阳离子交换膜,左侧溶液质量将_______,(填“增大”“减小”或“不变”),且变化了_____克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡的标志的是()
2C(g)达到平衡的标志的是()
(1)C的生成速率与C的分解速率相等;
(2)单位时间内生成amol A,同时生成3amol B;
(3)A、B、C的浓度不再变化;
(4)混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化;
(6)单位时间消耗amol A,同时生成3amol B;
(7)A 、B、C的分子数目比为1:3:2。
A.(2)(5)B.(1)(3)C.(2)(7)D.(5)(6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 时,
时,![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() 。
。
![]() 溶液和NaHA溶液反应的主要离子方程式为________________________________
溶液和NaHA溶液反应的主要离子方程式为________________________________![]() 不考虑
不考虑![]() 与
与![]() 发生氧化还原反应
发生氧化还原反应![]() 。
。
![]() 溶液中离子浓度由大到小的顺序为 ____________________________。
溶液中离子浓度由大到小的顺序为 ____________________________。
![]() 时,将
时,将![]() 的HCOOH溶液和
的HCOOH溶液和![]() 的
的![]() 溶液分别与
溶液分别与![]() 的
的![]() 溶液混合,实验测得产生的气体体积
溶液混合,实验测得产生的气体体积![]() 随时间
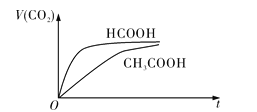
随时间![]() 变化的示意图如图所示:
变化的示意图如图所示:
![]() 的电离平衡常数表达式
的电离平衡常数表达式![]() __________________________。
__________________________。
![]() 反应初始阶段,两种溶液产生
反应初始阶段,两种溶液产生![]() 气体的速率存在明显差异的原因是__________________________________________________________________________________,反应结束后所得两溶液中,
气体的速率存在明显差异的原因是__________________________________________________________________________________,反应结束后所得两溶液中,![]() ____________
____________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
![]() 时,某溶液中含有
时,某溶液中含有![]() 、
、![]() 加入KOH固体以调节溶液
加入KOH固体以调节溶液![]() 忽略溶液体积的变化、忽略
忽略溶液体积的变化、忽略 ![]() 的挥发和分解
的挥发和分解![]() 。当pH为7时,能否有
。当pH为7时,能否有![]() 沉淀生成?________
沉淀生成?________![]() 填“能”或“否”
填“能”或“否”![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下的四种溶液:①pH=9的 NaOH 溶液 ②pH=9的CH3COONa溶液 ③pH=5的H2SO4溶液 ④pH=5的NaHSO4 溶液,溶液中由水电离产生的c(OH-)相同的是( )
A.①②B.①③C.③④D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿![]() 主要成分
主要成分![]() ,含
,含![]() 、
、![]() 等杂质
等杂质![]() 冶炼铝的主要流程如图:
冶炼铝的主要流程如图:

![]() 注:
注:![]() 碱溶时转变为铝硅酸钠沉淀
碱溶时转变为铝硅酸钠沉淀![]()
下列叙述错误的是( )
A.操作I增大NaOH溶液用量可提高![]() 的浸取率
的浸取率
B.操作Ⅱ、Ⅲ为过滤,操作Ⅳ为灼烧
C.通入过量![]() 的离子方程式为
的离子方程式为![]()
D.加入的冰晶石目的是降低![]() 的熔融温度
的熔融温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取自来水的装置示意图,根据图示回答下列问题。

(1)图中的两处明显的错误是____________________、_____________________。
(2)A仪器的名称是______________,B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,还需加入少量___________,其作用是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com