
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡的标志的是()
2C(g)达到平衡的标志的是()
(1)C的生成速率与C的分解速率相等;
(2)单位时间内生成amol A,同时生成3amol B;
(3)A、B、C的浓度不再变化;
(4)混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化;
(6)单位时间消耗amol A,同时生成3amol B;
(7)A 、B、C的分子数目比为1:3:2。
A.(2)(5)B.(1)(3)C.(2)(7)D.(5)(6)
【答案】C
【解析】
(1)C的生成速率与C的分解速率相等,说明正、逆反应速率相等,达到平衡状态,故正确;
(2)根据方程式,单位时间内amolA生成,同时必定生成3amolB,都体现的逆反应速率,不能说明正、逆反应速率的关系,故错误;
(3)A、B、C的浓度不再变化,说明达平衡状态,故正确;
(4)该反应为气体物质的量发生变化的反应,混合气体的总压强不再变化,说明各物质的量不变,反应达平衡状态,故正确;
(5)该反应为气体物质的量发生变化的反应,混合气体的物质的量不再变化,说明各物质的量不变,反应达平衡状态,故正确;
(6)单位时间消耗amolA,等效于消耗3amolB,同时生成3amolB,正、逆反应速率相等,反应达平衡状态,故正确;
(7)平衡时A、B、C的分子数目比为1∶3∶2,不能说明浓度是否不变,不能说明是平衡状态,故错误;
不能说明达到平衡状态的有(2)(7),故选C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是![]()
A.![]() 易液化,氨常用作制冷剂
易液化,氨常用作制冷剂
B.胆矾遇浓硫酸变白是因为浓硫酸的脱水性
C.氨催化氧化制硝酸过程中的三个主要反应都属于氧化还原反应
D.浓硝酸需保存在棕色瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是学习理解化学知识的基础,它以其魅力和丰富的内涵在化学学习中发挥着独特的功能和作用。请回答下列问题:
实验室欲配制100mL1mol·L-1的Na2CO3溶液。
(1)配制上述溶液,下列没有用到的仪器是__(填标号)。
A.烧杯 B.大试管 C.胶头滴管 D.100mL容量瓶
(2)除上述仪器外,还一定用到的玻璃仪器是__。
(3)从下表中选择称量Na2CO3·10H2O固体所需要的仪器有__(填标号)。
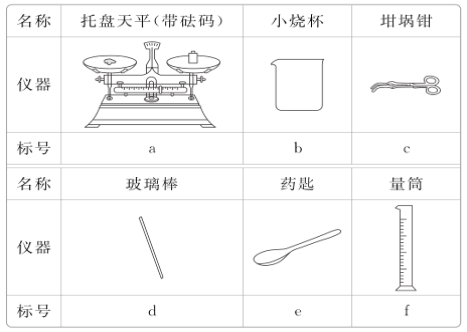
(4)下列情况使所配溶液的浓度如何变化?
①未洗涤溶解Na2CO3·10H2O的烧杯__(填“偏大”“偏小”或“不变”,后同)。
②容量瓶使用前用蒸馏水洗过,内壁附有水珠__。
③定容时加蒸馏水超过了刻度线,将多出的液体吸出__。
④定容时俯视容量瓶刻度线__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换等方面应用广泛。
(1)①钢铁在海水中容易发生电化学腐蚀,正极反应式是__________。
②图中,为减缓钢闸门的腐蚀,材料B可以选择__________(填“Zn”或“Cu”)。
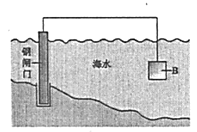
(2)如图为钢铁防护模拟实验装置,则铁做__________极,检测钢铁保护效果的方法是:取少量铁电极附近的溶液于试管中,_________,则说明保护效果好。

(3)氢氧燃料电池是一种新型的化学电源,其构造如图所示:

a、b为多孔石墨电极,通入的气体由孔隙中逸出,并在电极表面放电。
①a的电极反应式是_________;
②若电池共产生3.6g水,则电路中通过了_______mol的电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志·南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为___,3d能级上的未成对电子数为___。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液。
①[Ni(NH3)6]SO4中阴离子的立体构型是___。
②在[Ni(NH3)6]2+中Ni2+与NH3之间形成的化学键称为___,提供孤电子对的成键原子是___。
③氨的沸点___(填“高于”或“低于”)膦(PH3),原因是___。
(3)单质铜及镍都是由___键形成的晶体;元素铜与镍的第二电离能分别为ICu=1958kJ·mol-1、INi=1753kJ·mol-1,ICu>INi的原因是___。
(4)某镍白铜合金的立方晶胞结构如图所示。
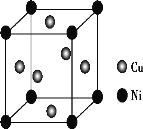
①晶胞中铜原子与镍原子的数量比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为番茄电池,下列说法正确的是( )
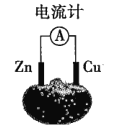
A.锌电极是该电池的正极B.铜电极附近会出现蓝色
C.一段时间后,锌片质量会变小D.电子由铜通过导线流向锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烷烃和气态单烯烃组成的混合气体,其密度是同条件下H2密度的13倍,把标准状况下2.24 L,该混合体通入足量的溴水中,溴水增重1.4 g。
(1)该混合烃的平均摩尔质量为________;其中一定含有________(写名称)。
(2)通过简计算,确定另一种烃的分子组成:_________。
(3)写出该混合烃中单烯烃所有可能的异构体(考虑顺反异构)任意写两种________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,10mL0.40mol/L H2O2发生催化分解。不同时刻测定生成O2的体积(已折算为标准状况)如下表。
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
下列叙述不正确的是(溶液体积变化忽略不计)
A.0~6min的平均反应速率:v(H2O2)![]()
![]() mol/(L·min)
mol/(L·min)
B.6~10min的平均反应速率:v(H2O2)<![]() mol/(L·min)
mol/(L·min)
C.反应至6min时,c(H2O2)=0.3mol/L
D.反应至6min时,H2O2分解了50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究![]() 、NO、
、NO、![]() 、CO等大气污染气体的处理具有重要意义。
、CO等大气污染气体的处理具有重要意义。
(1)已知:CO可将部分氮的氧化物还原为![]() 。
。
反应I:![]()
反应II:![]()
则反应![]() 的
的![]() =___________kJ·mol-1。
=___________kJ·mol-1。
(2)一定条件下,将![]() 与CO以体积比1∶2置于恒容密闭容器中发生反应II,下列能说明反应达到平衡状态的是________________。
与CO以体积比1∶2置于恒容密闭容器中发生反应II,下列能说明反应达到平衡状态的是________________。
a. 体系压强保持不变 b. 容器中气体密度保持不变
c. 混合气体颜色保持不变d. 每消耗![]() 的同时生成
的同时生成![]()
(3)温度为T 容积为10L的恒容密闭容器中,充入1molCO和0.5mol![]() 发生反应:
发生反应:
![]() 实验测得生成的
实验测得生成的![]() 体积分数
体积分数![]() 随着时间的变化曲线如图1所示:
随着时间的变化曲线如图1所示:
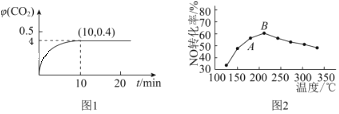
①达到平衡状态时,![]() 的转化率为______,该温度下反应的平衡常数
的转化率为______,该温度下反应的平衡常数![]() _________。
_________。
②其它条件保持不变,再向上述平衡体系中充入![]() 、
、![]() 、
、![]() 、
、![]() 各
各![]() ,此时V(正)__________ V(逆)填“﹥”“ <”或“=”。
,此时V(正)__________ V(逆)填“﹥”“ <”或“=”。
4)![]() 法是工业上消除氮氧化物的常用方法,反应原理为
法是工业上消除氮氧化物的常用方法,反应原理为![]() ,在催化剂作用下,NO转化率与温度的关系如图2所示:图中A点处NO的转化率____________填“可能是”、“一定是”或“一定不是”该温度下的平衡转化率;B点之后,NO转化率降低的原因可能是______。
,在催化剂作用下,NO转化率与温度的关系如图2所示:图中A点处NO的转化率____________填“可能是”、“一定是”或“一定不是”该温度下的平衡转化率;B点之后,NO转化率降低的原因可能是______。
A. 平衡常数变大 B. 副反应增多
C. 催化剂活性降低 D. 反应活化能增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com