
【题目】如图为番茄电池,下列说法正确的是( )
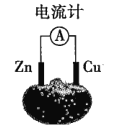
A.锌电极是该电池的正极B.铜电极附近会出现蓝色
C.一段时间后,锌片质量会变小D.电子由铜通过导线流向锌
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行以下实验,能得到相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓氨水 | NaOH | 酚酞 | NaOH 的碱性比 NH3·H2O 的强 | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 浓硫酸 | Cu | Na2S | SO2 具有氧化性 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3 | 非金属性:N>C>Si |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肯定属于同族元素且性质相似的是( )
A. 原子核外电子排布式:A为1s22s2,B为1s2
B. 结构示意图:A为![]() ,B为
,B为![]()
C. A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D. A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置(夹持已装置省略)进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀硫酸 | Na2CO3 | CaCl2溶液 | CO2可与氯化钙反应 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡的标志的是()
2C(g)达到平衡的标志的是()
(1)C的生成速率与C的分解速率相等;
(2)单位时间内生成amol A,同时生成3amol B;
(3)A、B、C的浓度不再变化;
(4)混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化;
(6)单位时间消耗amol A,同时生成3amol B;
(7)A 、B、C的分子数目比为1:3:2。
A.(2)(5)B.(1)(3)C.(2)(7)D.(5)(6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把活泼金属片a和b放在盛有稀食盐水和酚酞混合液的表面皿中,构成如图所示原电池,一段时间后观察到区域I变红色,则下列叙述正确的是( )
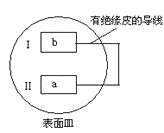
A.a是原电池的负极B.b的活泼性大于a
C.无电流产生D.b 电极上有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O.
某化学小组根据上述反应原理进行下列实验:
I.测定H2C2O4溶液的物质的量浓度
实验步骤如下:
①取待测H2C2O4溶液25.00mL放入锥形瓶中,再加入适量的稀硫酸;
②用0.1mol/LKMnO4溶液滴定至终点,记录数据;
③重复滴定2次,平均消耗KMnO4溶液20.00mL。
请回答:
(1)滴定时,将KMnO4溶液装在______(填“酸式”或“碱式”)滴定管中。
(2)若在步骤①操作之前,先用待测H2C2O4溶液润洗锥形瓶,则测得H2C2O4溶液的浓度会______(填“偏大”“偏小”或“无影响”)。
(3)步骤②中到达滴定终点时的现象为_______________________________。
(4)计算H2C2O4溶液的物质的量浓度为__________mol/L。
II.探究反应物浓度对化学反应速率的影响设计如下实验方案(实验温度均为25℃):
实验序号 | 体积V/mL | |||
0.1molL-1KMnO4溶液 | 0.11molL-1H2C2O4溶液 | 0.11molL-1H2SO4溶液 | H2O | |
① | 2.0 | 5.0 | 6.0 | 7.0 |
② | 2.0 | 8.0 | 6.0 | V1 |
③ | 2.0 | V2 | 6.0 | 2.0 |
请回答:
(5)表中v1=______。
(6)实验中需要测量的数据是______________________________。
(7)实验中______(填“能”或“不能”)用0.2mol/L盐酸代替0.1mol/LH2SO4溶液,理由是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1 L的密闭容器中,将CO和水蒸气的混合气体加热到800 ℃时,有下列平衡CO(g)+H2O(g)![]() CO2(g)+H2(g),且K=1,若用2 mol CO和10 mol H2O(g)相互混合并加热到800 ℃,则CO的转化率为( )
CO2(g)+H2(g),且K=1,若用2 mol CO和10 mol H2O(g)相互混合并加热到800 ℃,则CO的转化率为( )
A.16.7%B.50%C.66.7%D.83.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备K2FeO4的流程如下:
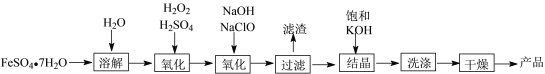
(1)配制FeSO4溶液时,需加入铁粉和稀硫酸,试说明加铁粉的原因______________________,加稀硫酸原因_______________________。
(2)用饱和KOH溶液结晶的原因是__________________。
(3)洗涤时用乙醚作洗涤剂的原因是_________________。
(4)经测定第一、二次氧化时的转化率分别为a和b,结晶时的转化率为c,若要制备d Kg的K2FeO4,则需要FeSO4·7H2O___________Kg。(K2FeO4的相对分子质量是198;FeSO4·7H2O的相对分子质量是278;答案用分数表示)
(5)电解法也能制备K2FeO4。用KOH溶液作电解液,在阳极可以将铁氧化成FeO![]() ,试写出此时阳极的电极反应式___________________________。
,试写出此时阳极的电极反应式___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com