
【题目】研究![]() 、NO、
、NO、![]() 、CO等大气污染气体的处理具有重要意义。
、CO等大气污染气体的处理具有重要意义。
(1)已知:CO可将部分氮的氧化物还原为![]() 。
。
反应I:![]()
反应II:![]()
则反应![]() 的
的![]() =___________kJ·mol-1。
=___________kJ·mol-1。
(2)一定条件下,将![]() 与CO以体积比1∶2置于恒容密闭容器中发生反应II,下列能说明反应达到平衡状态的是________________。
与CO以体积比1∶2置于恒容密闭容器中发生反应II,下列能说明反应达到平衡状态的是________________。
a. 体系压强保持不变 b. 容器中气体密度保持不变
c. 混合气体颜色保持不变d. 每消耗![]() 的同时生成
的同时生成![]()
(3)温度为T 容积为10L的恒容密闭容器中,充入1molCO和0.5mol![]() 发生反应:
发生反应:
![]() 实验测得生成的
实验测得生成的![]() 体积分数
体积分数![]() 随着时间的变化曲线如图1所示:
随着时间的变化曲线如图1所示:
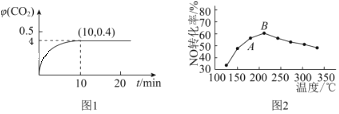
①达到平衡状态时,![]() 的转化率为______,该温度下反应的平衡常数
的转化率为______,该温度下反应的平衡常数![]() _________。
_________。
②其它条件保持不变,再向上述平衡体系中充入![]() 、
、![]() 、
、![]() 、
、![]() 各
各![]() ,此时V(正)__________ V(逆)填“﹥”“ <”或“=”。
,此时V(正)__________ V(逆)填“﹥”“ <”或“=”。
4)![]() 法是工业上消除氮氧化物的常用方法,反应原理为
法是工业上消除氮氧化物的常用方法,反应原理为![]() ,在催化剂作用下,NO转化率与温度的关系如图2所示:图中A点处NO的转化率____________填“可能是”、“一定是”或“一定不是”该温度下的平衡转化率;B点之后,NO转化率降低的原因可能是______。
,在催化剂作用下,NO转化率与温度的关系如图2所示:图中A点处NO的转化率____________填“可能是”、“一定是”或“一定不是”该温度下的平衡转化率;B点之后,NO转化率降低的原因可能是______。
A. 平衡常数变大 B. 副反应增多
C. 催化剂活性降低 D. 反应活化能增大
【答案】-277 ac 60% 3.375 ﹥ 一定不是 BC
【解析】
(1)根据盖斯定律分析计算;
(2)达到平衡状态时,正、逆反应速率相等,各物质的浓度不变,据此分析判断;
(3)①根据图象知达到平衡状态CO2体积分数为0.4,结合三段式,列式计算得到平衡浓度,再分析解答;②计算此时的浓度商和平衡常数的大小,判断反应进行的方向;
(4)根据可知开始NO转化率增大,是反应正向进行,逐渐建立平衡,达到最大转化率后,升高温度,平衡逆向移动,NO转化率减小,结合温度对催化剂的活性的影响分析解答。
(1)已知:CO可将部分氮的氧化物还原为N2。反应I:2CO(g)+2NO(g)N2(g)+2CO2(g)△H=-746kJmol-1,反应II:4CO(g)+2NO2(g)N2(g)+4CO2(g)△H=-1200kJmol-1,根据盖斯定律,(反应II-反应I)×![]() 得到反应NO2(g)+CO(g)CO2(g)+NO(g)△H=[(-1200kJmol-1)-(-746kJmol-1)]×
得到反应NO2(g)+CO(g)CO2(g)+NO(g)△H=[(-1200kJmol-1)-(-746kJmol-1)]×![]() =-227kJ/mol,故答案为:-227;
=-227kJ/mol,故答案为:-227;
(2)反应II:4CO(g)+2NO2(g)N2(g)+4CO2(g)△H=-1200kJmol-1,该反应为气体体积减小的放热反应。a.反应前后气体物质的量减小,气体的压强为变量,当体系压强保持不变,说明反应达到平衡状态,故a正确;b.反应前后气体质量和体积都不变,容器中气体密度始终保持不变,不能说明反应达到平衡状态,故b错误;c.混合气体颜色保持不变,说明气体中二氧化氮浓度不变,反应达到平衡状态,故c正确;d.每消耗2molNO2的同时生成1molN2,都表示正反应速率,不能说明反应达到平衡状态,故d错误;故答案为:ac;
(3)①根据图象知达到平衡状态CO2体积分数为0.4,设消耗二氧化硫物质的量浓度x,
2CO(g)+SO2(g)2CO2(g)+S(g)
起始量(mol/L) 0.1 0.05 0 0
变化量(mol/L) 2x x 2x x
平衡量(mol/L)0.1-2x 0.05-x 2x x
则![]() ×100%=0.4,解得:x=0.03mol/L,因此二氧化硫的转化率=
×100%=0.4,解得:x=0.03mol/L,因此二氧化硫的转化率=![]() ×100%=60%,平衡常数K=
×100%=60%,平衡常数K=![]() =3.375,故答案为:60%; 3.375;
=3.375,故答案为:60%; 3.375;
②其它条件保持不变,再向上述平衡体系中充入SO2(g)、CO(g)、S(g)、CO2(g)各0.2mol,
2CO(g) + SO2(g) 2CO2(g) + S(g)
起始量(mol/L) 0.1 0.05 0 0
变化量(mol/L) 0.06 0.03 0.06 0.03
平衡量(mol/L) 0.04 0.02 0.06 0.03
加入后(mol/L) 0.04+0.02 0.02+0.02 0.06+0.02 0.03+0.02
此时浓度商Qc=![]() =2.22<K=3.375,反应正向进行,v(正)>v(逆),故答案为:>;
=2.22<K=3.375,反应正向进行,v(正)>v(逆),故答案为:>;
(4)根据图象,温度升高NO转化率先增大后减小,图像的前半段是建立平衡的过程,后半段是温度对平衡的影响,因此A点NO的转化率一定不是该温度下的平衡转化率,B点之后,升高温度,平衡逆向移动,平衡常数减小,NO转化率降低,升高温度,催化剂的活性降低,发生的副反应增多,也会导致NO转化率降低,反应的活化能不影响反应物的转化率,故选BC,故答案为:一定不是;BC。


科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡的标志的是()
2C(g)达到平衡的标志的是()
(1)C的生成速率与C的分解速率相等;
(2)单位时间内生成amol A,同时生成3amol B;
(3)A、B、C的浓度不再变化;
(4)混合气体的总压强不再变化;
(5)混合气体的物质的量不再变化;
(6)单位时间消耗amol A,同时生成3amol B;
(7)A 、B、C的分子数目比为1:3:2。
A.(2)(5)B.(1)(3)C.(2)(7)D.(5)(6)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿![]() 主要成分
主要成分![]() ,含
,含![]() 、
、![]() 等杂质
等杂质![]() 冶炼铝的主要流程如图:
冶炼铝的主要流程如图:

![]() 注:
注:![]() 碱溶时转变为铝硅酸钠沉淀
碱溶时转变为铝硅酸钠沉淀![]()
下列叙述错误的是( )
A.操作I增大NaOH溶液用量可提高![]() 的浸取率
的浸取率
B.操作Ⅱ、Ⅲ为过滤,操作Ⅳ为灼烧
C.通入过量![]() 的离子方程式为
的离子方程式为![]()
D.加入的冰晶石目的是降低![]() 的熔融温度
的熔融温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下某水溶液中的![]() 、
、![]() 浓度变化曲线如图所示,下列说法不正确的是
浓度变化曲线如图所示,下列说法不正确的是
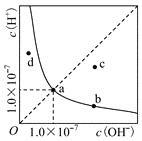
A.向蒸馏水中加入NaOH固体充分溶解后恢复至室温,溶液最终可能落在b点
B.![]() 与HCl的混合溶液中水电离出的
与HCl的混合溶液中水电离出的![]() 浓度可能等于d点坐标
浓度可能等于d点坐标
C.若b点表示盐NaR的水溶液,向其中逐滴滴入过量的HR溶液,会引起b向c的变化
D.若c点表示某温度下盐NaHA的水溶液,则![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能电池板材料除单晶硅外,还有氮、硼、硒、钛、钴、钙等元素组成的化学物质。
⑴钙原子基态时的电子排布式为____________________,金属钴堆积方式与镁相似,都属于六方最密堆积,其配位数是____。
⑵氮元素的第一电离能在同周期中(稀有气体除外)从大到小排第___位;写出与NO3-互为等电子体的一种非极性分子的化学式__________。
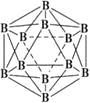
⑶晶体硼的结构单元是正二十面体,每个单元中有12个硼原子(如图),其中有两个原子为10B,其余为11B,则该结构单元有_____________种不同的结构类型。己知硼酸(H3BO3)为一元弱酸,解释其为一元弱酸的原因______________。硼酸的结构与石墨相似,层内的分子以氢键相连,含1 mol硼酸的晶体中有___mol氢键。
⑷硒是动物体必需的营养元素。SeO2是硒的重要化合物,SeO2的价层电子对互斥模型是_______________。
⑸在浓的TiCl3的盐酸溶液中加入乙醚,并通入HC1至饱和,可得到配位数为6,组成为 TiCl36H2O的晶体,该晶体中两种配体的物质的量之比为1:5,则该配离子的化学式为:__________________。
⑹钴晶体的一种晶胞是一种体心立方结构(如图所示),若该晶胞的边长为a nm,密度为ρ gcm-3,NA表示阿伏加德罗常数的值,则钴的相对原子质量可表示为_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备K2FeO4的流程如下:
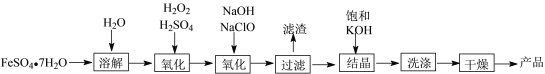
(1)配制FeSO4溶液时,需加入铁粉和稀硫酸,试说明加铁粉的原因______________________,加稀硫酸原因_______________________。
(2)用饱和KOH溶液结晶的原因是__________________。
(3)洗涤时用乙醚作洗涤剂的原因是_________________。
(4)经测定第一、二次氧化时的转化率分别为a和b,结晶时的转化率为c,若要制备d Kg的K2FeO4,则需要FeSO4·7H2O___________Kg。(K2FeO4的相对分子质量是198;FeSO4·7H2O的相对分子质量是278;答案用分数表示)
(5)电解法也能制备K2FeO4。用KOH溶液作电解液,在阳极可以将铁氧化成FeO![]() ,试写出此时阳极的电极反应式___________________________。
,试写出此时阳极的电极反应式___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制取自来水的装置示意图,根据图示回答下列问题。

(1)图中的两处明显的错误是____________________、_____________________。
(2)A仪器的名称是______________,B仪器的名称是_______________。
(3)实验时A中除加入少量自来水外,还需加入少量___________,其作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的结构决定性质。回答下列有关问题:
(1)BF3的空间构型为______。SO32-中心原子的杂化类型是______。
(2)H2S的沸点比H2O2的沸点______![]() 选填“高”或“低”
选填“高”或“低”![]() ;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
;氮化铝、氮化硼、氮化镓三种晶体的结构与金刚石类似,其中熔点最高的是______。
(3)从分子结构的角度分析“白磷不溶于水,易溶于CS2”的原因______。
(4)CuCl难溶于水但易溶于氨水,其原因是______;此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______。
(5)已知CaF2晶胞结构如图所示,晶体密度为![]() g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含
g/cm3,则晶胞的边长是______cm。(NA表示阿伏加德罗常数,用含![]() 、NA的代数式表达)
、NA的代数式表达)
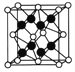
(6)一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,该晶体中原子之间的作用力是______;该晶体具有储氢功能,氢原子可进入到Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入NO2气体,发生反应2NO2(g)![]() N2O4(g):
N2O4(g):
(1)恒温恒压时,平衡后充入惰性气体,平衡___移动(填“正向”、“逆向”或“不”);
(2)平衡后慢慢压缩气体体积,平衡向右移动,混合气体颜色___(填“加深”、“变浅”或“不变”);
(3)若向体积为2L的恒容密闭容器中充入2molNO2,达到平衡状态时NO2转化率为a,向体积为2L的恒压密闭容器中充入2molNO2,达到平衡状态时NO2转化率为b,则a__b(填“>”、“<”或“=”);
(4)若向体积为2L的恒容密闭容器中充入2molNO2,达到平衡状态时NO2体积分数为a,再向该容器中继续充入1molN2O4,达到新平衡后NO2体积分数为b,则a__b(填“>”、“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com