
【题目】在一密闭容器中发生反应N2+3H22NH3 , 达到平衡后,只改变某一个条件时,反应速率与反应时间的关系如图所示: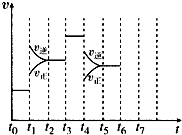
回答下列问题:
(1)处于平衡状态的时间段是(填选项).
A.t0~t1
B.t1~t2
C.t2~t3
D.t3~t4
E.t4~t5
F.t5~t6
(2)t1、t3、t4时刻分别改变的一个条件是(填选项).A.增大压强 B.减小压强 C.升高温度
D.降低温度 E.加催化剂 F.充入氮气
t1时刻;t3时刻;
(3)依据(2)中的结论,下列时间段中,氨的百分含量最高的是(填选项).
A.t0~t1
B.t2~t3
C.t3~t4
D.t5~t6
(4)一定条件下,合成氨反应达到平衡时,测得混合气体中氨气的体积分数为20%,则反应后与反应前的混合气体体积之比为 .
【答案】
(1)ACDF
(2)C;E
(3)A
(4)5:6
【解析】解:(1)根据图示可知,t0~t1、t2~t3、t3~t4、t5~t6时间段内,v正、v逆相等,反应处于平衡状态,所以答案是:ACDF;(2)由N2(g)+3H2(g)2NH3(g)△H<0,可知,该反应为放热反应,且为气体体积减小的反应,则由图可知,t1正逆反应速率均增大,且逆反应速率大于正反应速率,改变条件应为升高温度;t3时正逆反应速率均增大,且逆反应速率等于正反应速率,改变条件应为加催化剂,所以答案是:C;E;(3)由图可知,t1平衡逆向移动,t3不移动,t4平衡逆向移动,均使氨气的含量减少,则t0~t1氨气的含量最大,所以答案是:A;(4)设反应前加入a mol N2 , bmol H2 , 达平衡时生成2x mol NH3 , N2(g)+3H2(g)2NH3(g)
起始 a b0
转化 x 3x2x
平衡 a﹣x b﹣3x 2x
则反应后气体总的物质的量=(a+b﹣2x)mol, ![]() =0.2,解得:a+b=12x,故反应后与反应前的混合气体体积之比=
=0.2,解得:a+b=12x,故反应后与反应前的混合气体体积之比= ![]() =
= ![]() =
= ![]() ,所以答案是:5:6.
,所以答案是:5:6.
【考点精析】掌握化学平衡状态本质及特征是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效).


科目:高中化学 来源: 题型:
【题目】易混易错题组
Ⅰ.使用正确的化学用语填空
(1)写出下列物质的电子式
氮气_______ 过氧化钠 _________ 四氯化碳________
(2)写出下列物质的结构式
二氧化碳 ________过氧化氢 _________ 次氯酸________
(学法题)正确书写化合物的电子式需要注意的问题是_____________
Ⅱ.正确比较下列各组对应关系
(1)已知短周期元素的四种离子A2+、B+、C3-、D-具有相同的电子层结构,则这四种元素:
①原子序数由大到小的顺序为:___________
②原子半径由大到小的顺序为:___________
③离子半径由大到小的顺序为:___________
(2)比较下列微粒半径大小,用“>”或“<”填空
①F-________Cl- ②Fe2+________Fe3+ ③O2-_________Mg2+
(学法题)粒子半径大小比较方法(两点即可)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质:①乙醇;②苯酚;③乙醛;④丙烯酸(CH2=CHCOOH);⑤乙酸乙酯.其中与溴水、KMnO4酸性溶液、NaHCO3溶液都能反应的是( )
A.仅①③
B.仅②⑤
C.仅④
D.仅③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.01molL﹣1 NaOH溶液滴定20.00mL 0.01molL﹣1 CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( ) 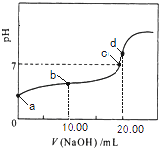
A.a点对应溶液的pH=2
B.b点对应的溶液中:c(OH﹣)+c(CH3COO﹣)=c(Na+)+c(H+)
C.c点表示NaOH溶液与CH3COOH溶液恰好完全反应
D.d点对应的溶液中,水的电离程度小于同温下纯水的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙醇分子中有一个羟基的事实是( )
A.乙醇完全燃烧生成CO2和H2O
B.0.1mol乙醇与足量钠反应生成0.05mol氢气
C.乙醇能溶于水
D.乙醇能脱水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按照物质的树状分类和交叉分类,HNO3应属于
①酸 ②氢化物 ③氧化物 ④含氧酸 ⑤难挥发性酸⑥强酸 ⑦一元酸 ⑧化合物 ⑨混合物
A. ①②③④⑤⑥⑦⑧B. ①④⑥⑦⑧
C. ①⑨D. ①④⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能,甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455kJ/mol,甲醚可作燃料电池的燃料.
(1)写出甲醚燃烧的热化学方程式;已知H2(g)和C(s)的燃烧热分别是285.8kJmol﹣1、393.5kJmol﹣1;计算反应
4C(s)+6H2(g)+O2(g)═2CH3OCH3(g)的反应热为;
(2)工业上利用H2和CO2合成二甲醚的反应如下:6H2(g)+2CO2(g)═CH3OCH3(g)+3H2O(g)△H<0①一定温度下,在一个固定体积的密闭容器中进行该反应.下列能判断反应达到化学平衡状态的是(选填编号,注意大小写)
a.c(H2)与c(H2O)的比值保持不变 b.单位时间内有2mol H2消耗时有1mol H2O生成
c.容器中气体密度不再改变 d.容器中气体压强不再改变
②温度升高,该化学平衡移动后到达新的平衡,CH3OCH3的产率将(填“变大”、“变小”或“不变”,下同),混合气体的平均式量将;
(3)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池的负极反应式为;当燃料电池消耗2.8LO2(标准状况下)时,计算此时:NaCl溶液的pH=(假设溶液的体积不变,气体全部从溶液中逸出).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲通过实验验证氯元素的非金属性强于硫元素。请帮他们完成实验报告。
(1)他们将过量硫粉与少量铁粉混合后隔绝空气加热,制得并分离出固体产物A。
实验步骤和操作 | 实验现象 | 实验结论或解释 |
①取少量A于试管中,加入足量稀硫酸 | 固体完全溶解,产生有臭鸡蛋气味的气体B | 硫粉与铁粉混合后隔绝空气加热,制得固体产物A是______(填化学式) |
②将B通入足量水中 | 得到无色溶液C | |
③向①的试管中加入KSCN溶液 | 溶液无明显变化 | |
④将浓盐酸滴到KMnO4固体上 | 产生黄绿色气体 | 反应生成氯气 |
⑤将红热的铁丝(少量)伸入上述黄绿色气体中 | 铁丝剧烈燃烧,产生大量棕黄色的烟 | 反应的化学方程式为 _________________ |
⑥将⑤中所得固体产物溶于水,在所得溶液中滴加KSCN溶液 | 观察到______________(填现象) |
(2)综合上述实验现象和结论,______(填“能”或“不能”)验证氯元素的非金属性强于硫元素,理由是__________________________________________________。
(3)某同学将上述实验中④所得氯气直接通入无色溶液C中,观察到产生淡黄色固体,反应的化学方程式为_______________________________,此实验______(填“能”或“不能”)验证氯元素的非金属性强于硫元素。
(4)某同学认为将步骤①中的稀硫酸换成稀盐酸,若同样产生有臭鸡蛋气味的气体B,则可以说明氯元素的非金属性强于硫元素,他的观点________(填“正确”或“错误”),原因是_________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com