
高锰酸钾可用于除去地下水的硫化氢异味的原理是生成的硫和二氧化锰等沉淀物可过滤除去。水体呈弱酸性时,高锰酸钾的还原产物是MnO和MnO2,且MnO和MnO2的物质的量比为3:1。
(1)写出并配平上述化学方程式,标出电子转移方向与数目。
KMnO4 + H2S +H2SO4 →
在处理饮用水时,活性炭应在高锰酸钾反应结束后投加,否则会发生反应:
KMnO4 + C +H2O →MnO2 + X +K2CO3 (未配平)
(2)X的化学式为__________。
(3) 1mol氧化剂被______(填“氧化”或“还原”)时,生成_____mol氧化产物
(1)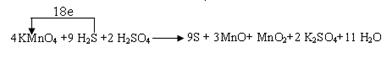 (4分)
(4分)
(2)KHCO3 (2分)
(3)还原 ,0.75 (各1分,共2分)
解析试题分析:(1)由题目信息可知,KMnO4、H2S、H2SO4反应生成S、MnO、MnO2,同时还生成K2SO4、H2O,生成MnO和MnO2的物质的量比为3:1。其中Mn元素的 化合价从+7价降低+2价和+4价,S元素的化合价从-2价升高到0价,设MnO和MnO2的系数分别为为3、1,则根据电子转移守恒可知S的系数为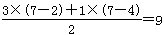 。根据原子守恒可知,KMnO4系数为4,H2S系数为9,K2SO4的系数为2,H2SO4的系数为2,H2O的系数为11,因此配平后方程式为:4KMnO4+9H2S+2H2SO4=9S+3MnO+MnO2+2K2SO4+11H2O,则反应中转移电子数目为9×[0-(-2)]=18,所以标出电子转移方向与数目为
。根据原子守恒可知,KMnO4系数为4,H2S系数为9,K2SO4的系数为2,H2SO4的系数为2,H2O的系数为11,因此配平后方程式为:4KMnO4+9H2S+2H2SO4=9S+3MnO+MnO2+2K2SO4+11H2O,则反应中转移电子数目为9×[0-(-2)]=18,所以标出电子转移方向与数目为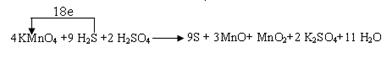 。
。
(2)反应中KMnO4→Mn02,Mn元素化合价由+7价降低为+4价,得到3个电子。C→K2CO3,C元素化合价由0价升高为+4价,失去4个电子。所以化合价升降最小公倍数为12,故KMnO4系数为4,C的系数为3,由C、K的原子数目关系可知K2CO3系数为1,因此X含有+4价的C原子、且C原子与K原子之比为1:1,所以X为KHCO3。
(3)反应中KMn04是氧化剂被还原,发生还原反应。氧化产物为KHCO3、K2CO3,每摩尔KHCO3、K2CO3都含1molC原子,设生成的氧化产物为amol,则根据电子转移守恒可知1mol×(7-4)=amol×(4-0),解得a=0.75。
考点:考查氧化还原反应的有关判断、计算以及配平等


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:填空题
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)下列生产、生活的事例中发生了氧化还原反应的是 。
(2)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原反应的关系”也可用如图表达。
试写出有水参加、水为还原剂且为类型Ⅳ的一个化学方程式: 。
(3)NaNO2是一种食品添加剂,它能致癌。酸性KMnO4溶液与NaNO2反应的离子方程式是:
①请补充完整,配平方程式并标出电子转移的方向和数目。
②某同学称取了7.9 g KMnO4,固体,欲配制100 mL溶液。回答下列问题:
该实验中,使用容量瓶时要检查是否漏水,其操作是 。
③不规范的实验操作会导致实验结果的误差。下列操作会使实验结果偏小的是 (填序号)。
A.在溶解过程中有少量液体溅出烧杯外
B.定容时仰视容量瓶上的刻度线
C.定容后,将容量瓶振荡摇匀后,静置发现液面低于刻度线,于是又加入少量水至刻度线
④某同学用上述配好的KMnO4溶液滴定未知浓度的NaNO2溶液:取20 mL未知浓度的NaNO2溶液于锥形瓶;取上述配好的KMnO4溶液于________(填“酸式”或“碱式”)滴定管,滴定完成后消耗KMnO4溶液10 mL,则NaNO2溶液的浓度为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
通过对模型、图形、图表的观察,能获取有关信息是化学学习的一种重要能力。按要求回答下列问题。
(1) 现有下列短周期元素性质的部分数据,其中X数值是表示不同元素的原子在分子内吸引电子的能力大小,若X值越大,其原子吸引电子能力越强,在所形成的分子中成为带负电荷一方: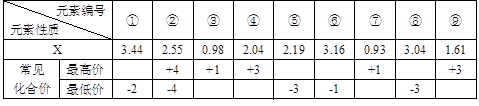
写出下列编号所代表的元素符号:①____,②____,④____,⑤____,⑥____。
(2) 已知4种无机化合物在水中和液氨中的溶解度(g/100g溶剂)为: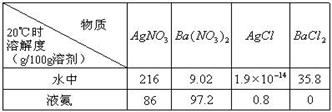
由上表的数据可知,在水溶液中上述化合物发生复分解反应的化学方程式为______________________,在液氨溶液中发生复分解反应的化学方程式为______________________________________________。
(3) 某稀溶液中含有Fe(NO3)3、Cu(NO3)2、HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度和加入铁粉的物质的量之间的关系如右图所示。三种物质和铁发生反应的顺序为___________,第一步反应的离子方程式为________,由图可知溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为__________。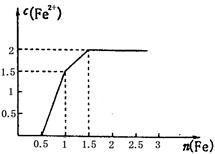
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Ⅰ.卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性
质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3- + I2 = 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2 + 3H2O ④ 2IO3- + 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
| 步骤 | 现象 |
| ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知33As、35Br位于同一周期。某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式是 。
(2)在该反应条件下可推知 (填序号)。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(3)该反应的氧化剂和还原剂的物质的量之比为__________; KBrO3与HBr反应也会生成X,则该反应中氧化剂和还原剂的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
高锰酸钾(KMnO4)是一种常用的氧化剂。
I.(1)有下列变化: ,找出其中一个变化与“
,找出其中一个变化与“ ”组成一个反应,写出该反应的离子方程式____ 。
”组成一个反应,写出该反应的离子方程式____ 。
(2)不同条件下高锰酸钾可发生如下反应:
 由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。
由此可知,高锰酸根离子(MnO—4)反应后的产物与 有关。
(3)高锰酸钾溶液与硫化亚铁有如下反应:
若上述反应前后固体的质量减少了2.8g,则硫元素与KMnO4之间发生电子转移的数目为 个。
Ⅱ.酒后驾车已成为一个社会问题。检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种。
(4)早期是利用检测试剂颜色变化定性判断BrAC,曾用如下反应检测BrAC:
完成并配平上述反应。
(5)受上述方法启发,后来用五氧化二碘的淀粉溶液检测BrAC,乙醇被氧化为乙醛,该反应的化学方程式为____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)己知KBrO3在反应中得到电子,则该反应的还原剂是_____________。
(2)已知0.2mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,井标出电子转移的方向和数目: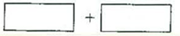
(4)溶液的酸碱性对氧化还原反应的方向有密切的关系。对于反应:AsO33-+I2+2OH- AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。
AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
在50 mL a mol·L-1的硝酸溶液中,加入6.4g Cu,全部溶解,假设硝酸的还原产物只有NO2和NO,将反应后溶液用蒸馏水稀释至100 mL时测得c(NO3-)=3 mol·L-1。
(1)求稀释后的溶液中H+的物质的量浓度
(2)若a=9,求生成的气体中NO2的物质的量
(3)治理氮氧化物污染的方法之一是用NaOH溶液进行吸收,反应原理如下:
NO2+NO+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O。若将上述的NO2和NO的混合气体通入1 mol·L-1的NaOH溶液恰好被吸收,求需要NaOH溶液的体积。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
已知稀溴水和氯化铁溶液都呈黄色。现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色,现对溶液呈黄色的原因进行探究。
(1)限选用的试剂有:酸性高锰酸钾溶液、氢氧化钠溶液、四氯化碳、硫氰化钾溶液、硝酸银溶液、淀粉—碘化钾溶液。请完成以下实验探究过程:
【提出假设】
假设1:溶液呈黄色不是发生化学反应所致,是溶液中 引起的(填微粒的化学
式,下同)。
假设2:溶液呈黄色是发生化学反应所致,是溶液中 引起的。
【设计实验方案】
为了验证上述假设1和假设2的推断,请用简要的文字说明你的实验方案:
假设1方案: 。
假设2方案: 。
(2)根据高中所学的知识判断,你认为 (填“假设1”或“假设2”)的推断是正确的;若选用淀粉—碘化钾溶液验证你的假设是否可行? (填“可行”或“不可行”),理由是 。
(3)若向稀溴化亚铁溶液中通入过量氯气,反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com