
【题目】某溶液中存在较多的OH—、K+、CO32—,该溶液中还可能大量存在的是
A. H+ B. Ca2+ C. NH4+ D. SO42—
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下列原子或离子的电子排布式或排布图正确的是________(填序号,下同),违反能量最低原理的是____________,违反洪特规则的是________,违反泡利原理的是________。
①Ca2+:1s22s22p63s23p6 ②F-:1s22s23p6
③P:![]() ④Cr:1s22s22p63s23p63d44s2
④Cr:1s22s22p63s23p63d44s2
⑤Fe:1s22s22p63s23p63d64s2 ⑥Mg2+:1s22s22p6⑦C:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠的叙述中,不正确的是( )
A.钠是银白色金属、有金属光泽B.钠的密度比水大比煤油小
C.钠具有很强的还原性D.钠燃烧时生成淡黄色固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列结论错误的是 ( )

A. 完全电解2 mol H2O断裂的σ键键数为4NA
B. 标准状况下,11.2 L CO2中含有的π键键数为2NA
C. 60 g SiO2晶体中含有的Si—O键键数为4NA
D. 128 g金属铜中含有如图所示的晶胞数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是有色金属,被广泛地应用于电气、轻工、机械制造、建筑工业、国防工业等领域,铜的冶炼和加工对于现代社会有着重要的意义。
(1)工业上可用黄铜矿冶炼粗铜,简要流程如下:
![]()
在转炉中,经过两步反应生成粗铜,其的热化学方程式分别为:
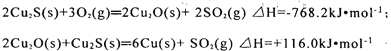
则总反应的热化学方程式为:_______________________________________;
(2)粗铜可用电解法精炼,电解过程中,粗铜应做____极;精铜一侧电极反应式为__________;
(3)电解精炼时粗铜中Fe、Zn等杂质元素会进入电解质溶液,一段时间后需要对电解液除杂净化,其中除去铁元素的一种操作如下:
![]()
下表为部分阳离子以氢氧化物形式沉淀时溶液的pH:

①试剂a是_______________,其作用是_________________________________________;
②溶液A加入CuO调节pH的目的是________________________________________(用必要的离子方程式和适当的文字说明)。
③操作①名称是________________。
(4)电解槽阳极泥中含有Ag、Au等贵金属,分离提纯Au的工艺流程如下:
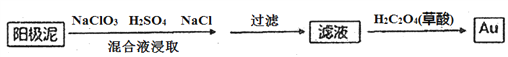
①滤液中Au元素的存在形式为[AuC14]-,写出浸取步骤反应的离子方程式________________。
②加入草酸后,滤液中发生氧化还原反应,生成Au单质,该反应中氧化剂和还原剂的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示。下列判断正确的是( )
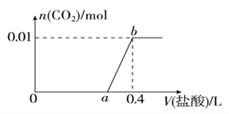
A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为:CO32-+2H+=H2O+CO2↑
C. a=0.3
D. 原混合溶液中NaOH与Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为________;Al与NaOH溶液反应的离子方程式为_________________________________________________________________。
(2)30Si原子的中子数为________;SiO2的晶体类型为________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al3O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解粗盐水(含Na+、Cl-和少量Mg2+、Br-)的装置如图所示(a、b均为石墨电极),下列说法正确的是

A. 电池工作时,负极反应式为:H2-2e-+2OH-=2H2O
B. a极的电极反应式为:2H++2e-=H2↑
C. 电解过程中电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D. 当电池中消耗2.24 L(标准状况下)H2时,b极周围会产生0.1 mol气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型之间的关系如图所示,下列化学反应属于阴影部分的是
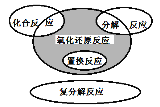
A. Cl2+2NaBr=== 2NaCl2+Br2
B. 4Fe(OH)2+O2+2H2O===4Fe(OH)3
C. 2NaHCO3![]() Na2CO3+CO2↑+ H2O
Na2CO3+CO2↑+ H2O
D. CH4 + 2O2 ![]() CO2 + 2H2O
CO2 + 2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com