
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为________;Al与NaOH溶液反应的离子方程式为_________________________________________________________________。
(2)30Si原子的中子数为________;SiO2的晶体类型为________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al3O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为________。
【答案】 ![]() 2Al+2OH-+2H2O===2AlO2-+3H2↑ 16 原子晶体 HCl CO2 25%
2Al+2OH-+2H2O===2AlO2-+3H2↑ 16 原子晶体 HCl CO2 25%
【解析】(1)Al的原子结构示意图为![]() ;Al与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O===2AlO2-+3H2↑;(2)30Si的质子数为14,质量数为30,因此中子数为30-14=16。SiO2的晶体类型为原子晶体;(3)Yn-离子的形成可排除第ⅣA族元素,根据气态氢化物显酸性判断Y为第ⅦA族元素(第ⅥA族的H2O为中性,第ⅤA族的NH3的水溶液显碱性),该族元素形成的气态氢化物均为分子晶体,由于HF中含有氢键,使其熔沸点较高,其余氢化物由于结构相似,因此相对分子质量越小者,熔沸点越低,所以HCl的沸点最低。(4)根据药皮的组成可以确定,在高温条件下,大理石发生分解:CaCO3
;Al与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O===2AlO2-+3H2↑;(2)30Si的质子数为14,质量数为30,因此中子数为30-14=16。SiO2的晶体类型为原子晶体;(3)Yn-离子的形成可排除第ⅣA族元素,根据气态氢化物显酸性判断Y为第ⅦA族元素(第ⅥA族的H2O为中性,第ⅤA族的NH3的水溶液显碱性),该族元素形成的气态氢化物均为分子晶体,由于HF中含有氢键,使其熔沸点较高,其余氢化物由于结构相似,因此相对分子质量越小者,熔沸点越低,所以HCl的沸点最低。(4)根据药皮的组成可以确定,在高温条件下,大理石发生分解:CaCO3![]() CaO+CO2↑,即气体是二氧化碳。(5)Fe2O3、Al2O3以及SiO2的混合物中加入过量盐酸,发生的反应为Fe2O3+6H+===2Fe3++3H2O,Al2O3+6H+===2Al3++3H2O,只有SiO2不反应,因此得到的11.0 g固体是SiO2。在滤液中加入过量的NaOH溶液,发生的反应为Al3++4OH-===AlO2-+2H2O,Fe3++3OH-===Fe(OH)3↓,因此得到的21.4 g固体是Fe(OH)3,其物质的量为0.2 mol,根据质量守恒得熔渣中Fe2O3的物质的量为0.1 mol,质量为16 g,所以熔渣中Al2O3的质量为36.0 g-11.0 g-16 g=9.0 g,在熔渣中的质量分数为9g/36g×100%=25%。
CaO+CO2↑,即气体是二氧化碳。(5)Fe2O3、Al2O3以及SiO2的混合物中加入过量盐酸,发生的反应为Fe2O3+6H+===2Fe3++3H2O,Al2O3+6H+===2Al3++3H2O,只有SiO2不反应,因此得到的11.0 g固体是SiO2。在滤液中加入过量的NaOH溶液,发生的反应为Al3++4OH-===AlO2-+2H2O,Fe3++3OH-===Fe(OH)3↓,因此得到的21.4 g固体是Fe(OH)3,其物质的量为0.2 mol,根据质量守恒得熔渣中Fe2O3的物质的量为0.1 mol,质量为16 g,所以熔渣中Al2O3的质量为36.0 g-11.0 g-16 g=9.0 g,在熔渣中的质量分数为9g/36g×100%=25%。


科目:高中化学 来源: 题型:
【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(S)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=______,该条件下的平衡常数K=_______________。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=______________。
(3)工业上可以用氨水除去反应C(s)+2NO(g)![]() N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O
N2(g)+CO2(g)中产生的CO2,得到NH4HCO3溶液,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5, H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
NH3·H2O+H2CO3的平衡常数K=________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5, H2CO3的电离平衡常数Ka1=4×10-7,Ka2=4×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式错误的是( )
A.向碳酸氢钙溶液中加过量氢氧化钠Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3·H2O+H2O
C.氢氧化铝与足量盐酸反应 Al(OH)3+3H+=Al3++3H2O
D.过量CO2通入氢氧化钠溶液中 CO2+2OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实现下列物质之间的转化,需要加入还原剂才能实现的是( )
A. HCl→Cl2 B.Cl2→HClOC.Na→Na2OD.CuSO4 → Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
原子半径(nm) | 0.186 | 0.160 | 0.152 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
回答下列问题:
(1)⑧在元素周期表中的位置是(周期、族)____________________。
(2)8个元素的最高价氧化物的水化物中,酸性最强的是___________________(填化学式)。
(3)①元素和⑥元素形成化合物的电子式是 ___________________________ 。
(4)写出④最高价氧化物对应水化物与⑥的氢化物水溶液反应的离子方程式:_______________________________________________ 。
(5)下列叙述正确的是______________(填字母)。
A.③、④处于不同周期
B.②的阳离子与⑧的阴离子的核外电子数相等
C.⑥在同主族元素中非金属性最强
D.⑤元素与⑦元素两者核电荷数之差是8
E.①与⑧形成的化合物具有两性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为1.18g·mL-1,其中镁离子的质量分数为5.1%。300mL该溶液中Cl—的物质的量约为
A. 0.37mol B. 0.63mol C. 0.74mol D. 1.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组取一定质量的镁铝合金材料投入200 mL稀硫酸中,待固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液体积(V)的关系如图所示。
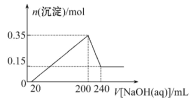
请回答下列问题:
(1)加入NaOH溶液0~20 mL时,发生反应的离子方程式为__________________________。
(2)加入NaOH溶液体积为220 mL时,沉淀的成分是________________________________。
(3)该合金材料中,镁、铝的物质的量之比为________________________。
(4)稀硫酸的物质的量浓度为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的叙述中错误的是( )
A. 金刚石中由共价键形成的最小的碳原子环上有六个碳原子
B. NaCl晶胞中共有4个Na+和4个Cl﹣
C. 在CsCl晶体中每个Cs+周围紧邻的有8个Cl﹣,而和每个Cs+等距离紧邻的也有8个Cs+
D. 在面心立方最密堆积的金属晶体中,每个金属原子周围紧邻的有12个金属原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com