
【题目】实现下列物质之间的转化,需要加入还原剂才能实现的是( )
A. HCl→Cl2 B.Cl2→HClOC.Na→Na2OD.CuSO4 → Cu
科目:高中化学 来源: 题型:
【题目】(3分)下列与化学概念有关的说法正确的是( )
A. 化合反应均为氧化还原反应
B. 金属氧化物均为碱性氧化物
C. 催化剂能改变可逆反应达到平衡的时间
D. 石油是混合物,其分馏产品汽油为纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,将足量的BaSO4固体溶于50mL水中,充分搅拌,慢慢加入Na2CO3固体,搅拌,溶液中随c(CO32-)增大时c(Ba2+)变化曲线如下图。则下列说正确的是

A. 20℃时Ksp(BaSO4)>Ksp(BaCO3)
B. 加入Na2CO3固体立即有BaCO3固体生成
C. BaCO3的Ksp=2.5×10-10
D. 曲线BC段内,c(CO32-):c(SO42-)=25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是有色金属,被广泛地应用于电气、轻工、机械制造、建筑工业、国防工业等领域,铜的冶炼和加工对于现代社会有着重要的意义。
(1)工业上可用黄铜矿冶炼粗铜,简要流程如下:
![]()
在转炉中,经过两步反应生成粗铜,其的热化学方程式分别为:
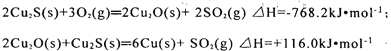
则总反应的热化学方程式为:_______________________________________;
(2)粗铜可用电解法精炼,电解过程中,粗铜应做____极;精铜一侧电极反应式为__________;
(3)电解精炼时粗铜中Fe、Zn等杂质元素会进入电解质溶液,一段时间后需要对电解液除杂净化,其中除去铁元素的一种操作如下:
![]()
下表为部分阳离子以氢氧化物形式沉淀时溶液的pH:

①试剂a是_______________,其作用是_________________________________________;
②溶液A加入CuO调节pH的目的是________________________________________(用必要的离子方程式和适当的文字说明)。
③操作①名称是________________。
(4)电解槽阳极泥中含有Ag、Au等贵金属,分离提纯Au的工艺流程如下:
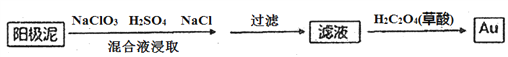
①滤液中Au元素的存在形式为[AuC14]-,写出浸取步骤反应的离子方程式________________。
②加入草酸后,滤液中发生氧化还原反应,生成Au单质,该反应中氧化剂和还原剂的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为________;Al与NaOH溶液反应的离子方程式为_________________________________________________________________。
(2)30Si原子的中子数为________;SiO2的晶体类型为________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al3O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温常压下,1molCO2中含有的原子数为3×6.02×1023
B. 用激光笔照射CuCl2溶液可产生“丁达尔效应”
C. 常温下,铁片能溶于浓硫酸
D. Na在空气中燃烧时发出耀眼的白光,可用于制造信号弹
查看答案和解析>>
科目:高中化学 来源: 题型:
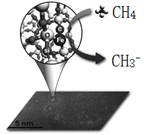
【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,如图所示。
物质 | 燃烧热(kJ/mol) |
氢气 | 285.8 |
甲烷 | 890.3 |
乙烯 | 1411.5 |
(1)已知相关物质的燃烧热如上表,写出甲烷制备乙烯的热化学方程式_________。
(2)在400℃时,向1L的恒容反应器中充入1molCH4,发生上述反应,测得平衡混合气体中C2H4的体积分数为20.0 %。则在该温度下,其平衡常数K=_______。按化学平衡移动原理,在图(a)中画出该反应的平衡转化率与温度及压强(p1>p2)的关系曲线。_______________________
(3)在制备C2H4时,通常存在副反应:2CH4(g)![]() C2H6(g)+H2(g)。在常温下,向体积为1L的恒容反应器中充入1molCH4,然后不断升高温度,得到图(b)。
C2H6(g)+H2(g)。在常温下,向体积为1L的恒容反应器中充入1molCH4,然后不断升高温度,得到图(b)。
①在200℃时,测出乙烷的量比乙烯多的主要原因是_________________________。
②在600℃后,乙烯的体积分数减少的主要原因是__________________________。

(4)工业上常采用除杂效率高的吸收-电解联合法,除去天然气中的杂质气体H2S,并转化为可回收利用的单质硫,其装置如下图所示。

通电前,先通入一段时间含H2S的甲烷气,使部分NaOH吸收H2S转化为Na2S,再接通电源,继续通入含杂质的甲烷气,并控制好通气速率。装置中右端碳棒为_________极,左端碳棒上的电极反应为_________________________,右池中的c(NaOH):c(Na2S)______________(填“增大”、“基本不变”或“减小)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com