
【题目】某氯化镁溶液的密度为1.18g·mL-1,其中镁离子的质量分数为5.1%。300mL该溶液中Cl—的物质的量约为
A. 0.37mol B. 0.63mol C. 0.74mol D. 1.5mol
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:
【题目】下图中的曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质):
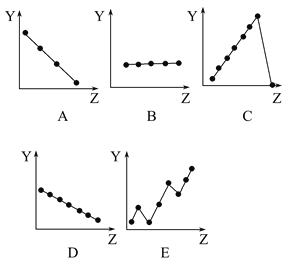
把与元素有关性质相符的曲线的标号填入相应括号中:
(1)ⅡA族元素原子的价电子数___________;
(2)第三周期元素的最高正化合价___________;
(3)F-、Na+、Mg2+、Al3+四种离子的离子半径___________;
(4)第二周期元素的原子半径(不包括稀有气体) ___________;
(5)第二周期元素的第一电离能 ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是有色金属,被广泛地应用于电气、轻工、机械制造、建筑工业、国防工业等领域,铜的冶炼和加工对于现代社会有着重要的意义。
(1)工业上可用黄铜矿冶炼粗铜,简要流程如下:
![]()
在转炉中,经过两步反应生成粗铜,其的热化学方程式分别为:
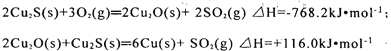
则总反应的热化学方程式为:_______________________________________;
(2)粗铜可用电解法精炼,电解过程中,粗铜应做____极;精铜一侧电极反应式为__________;
(3)电解精炼时粗铜中Fe、Zn等杂质元素会进入电解质溶液,一段时间后需要对电解液除杂净化,其中除去铁元素的一种操作如下:
![]()
下表为部分阳离子以氢氧化物形式沉淀时溶液的pH:

①试剂a是_______________,其作用是_________________________________________;
②溶液A加入CuO调节pH的目的是________________________________________(用必要的离子方程式和适当的文字说明)。
③操作①名称是________________。
(4)电解槽阳极泥中含有Ag、Au等贵金属,分离提纯Au的工艺流程如下:
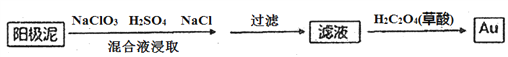
①滤液中Au元素的存在形式为[AuC14]-,写出浸取步骤反应的离子方程式________________。
②加入草酸后,滤液中发生氧化还原反应,生成Au单质,该反应中氧化剂和还原剂的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用于金属焊接的某种焊条,其药皮由大理石、水泥、硅铁等配制而成。
(1)Al的原子结构示意图为________;Al与NaOH溶液反应的离子方程式为_________________________________________________________________。
(2)30Si原子的中子数为________;SiO2的晶体类型为________。
(3)Al3+与Yn-的电子数相同,Y所在族各元素的氢化物的水溶液均显酸性,则该族氢化物中沸点最低的是________。
(4)焊接过程中,药皮在高温下产生了熔渣和使金属不被氧化的气体,该气体是________。
(5)经处理后的熔渣36.0 g(仅含Fe2O3、Al3O3、SiO2),加入足量稀盐酸,分离得到11.0 g固体;滤液中加入过量NaOH溶液,分离得到21.4 g固体;则此熔渣中Al2O3的质量分数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 常温常压下,1molCO2中含有的原子数为3×6.02×1023
B. 用激光笔照射CuCl2溶液可产生“丁达尔效应”
C. 常温下,铁片能溶于浓硫酸
D. Na在空气中燃烧时发出耀眼的白光,可用于制造信号弹
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解粗盐水(含Na+、Cl-和少量Mg2+、Br-)的装置如图所示(a、b均为石墨电极),下列说法正确的是

A. 电池工作时,负极反应式为:H2-2e-+2OH-=2H2O
B. a极的电极反应式为:2H++2e-=H2↑
C. 电解过程中电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D. 当电池中消耗2.24 L(标准状况下)H2时,b极周围会产生0.1 mol气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com