
【题目】I. 已知4℃时四种化合物在水中和液氨中的溶解度如下表:
AgNO3 | Ba(NO3)2 | AgCl | BaCl2 | |
H2O(液) | 170g | 9.2g | 1.5×10-4g | 33. 3g |
NH3(液) | 86g | 97.2g | 0.8g | 0g |
上述四种物质在水中形成复分解反应的离子方程式为_____________________,在液氨中形成复分解反应的化学方程式为______________________________。
II. 现有下列十种物质:①H2 ②铝 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦ 红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)上述十种物质中有两种物质之间可发生离子反应:H++OH-![]() H2O,该离子反应对应的化学方程式为 _____________________________________________
H2O,该离子反应对应的化学方程式为 _____________________________________________
(2)⑩在水中的电离方程式为 ____________________________________
(3)少量的④通入⑥的溶液中反应的离子方程式为_____________________________
过量的④通入⑥的溶液中反应的离子方程式为_______________________________
(4)⑥与过量的碳酸氢钠溶液反应离子方程式:_________________________________
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,
用双线桥标明电子转移的方向和数目__________________________________________,
当有5.4g Al发生反应时,转移电子的数目为 ____________ 。
【答案】Ag++Cl-=AgCl↓ Ba(NO3)2+2AgCl= BaCl2↓+2AgNO3 Ba(OH)2+2HNO3=Ba(NO3)2+2H2O Al2(SO4)3= 2Al3++3SO42- Ba2++2OH-+CO2=BaCO3↓+H2O CO2 + OH-=HCO3- Ba2++2OH-+2HCO3- =2H2O + BaCO3↓+CO32- 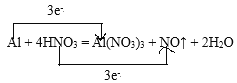 0.6NA或3.612×1023
0.6NA或3.612×1023
【解析】
I.由溶解度表可知,在水中AgCl不溶于水,在液氨中氯化钡不溶,则水中硝酸银与氯化钡发生复分解反应;液氨中硝酸钡与氯化银发生复分解反应。上述四种物质在水中形成复分解反应的离子有Ag+和Cl-,则离子方程式为Ag++Cl-=AgCl↓,液氨中硝酸钡与氯化银发生复分解反应,反应的离子方程式为:Ba(NO3)+2AgCl=2AgNO3+BaCl2↓;
II.水中因为氯化银的溶解度最小,所以氯离子与银离子生成氯化银,在液氨中因为氯化钡溶解度最小所以应生成更难溶的氯化钡。离子反应的条件之一由难溶的转变为更难溶的。
(1)H++OH-═H2O表示强酸与强碱反应生成可溶性盐与水的离子反应;
(2)Al2(SO4)3为强电解质,水溶液中完全电离;
(3)少量二氧化碳生成碳酸钡和水,过量二氧化碳生成碳酸氢钡;
(4)⑥与过量的碳酸氢钠溶液反应生成碳酸钡、碳酸钠和水;
(5)Al元素的化合价由0升高为+3价,以此计算转移电子数。
I.由溶解度表可知,在水中AgCl不溶于水,在液氨中氯化钡不溶,则水中硝酸银与氯化钡发生复分解反应;液氨中硝酸钡与氯化银发生复分解反应。上述四种物质在水中形成复分解反应的离子有Ag+和Cl-,则离子方程式为Ag++Cl-=AgCl↓,液氨中硝酸钡与氯化银发生复分解反应,反应的离子方程式为:Ba(NO3)+2AgCl=2AgNO3+BaCl2↓,
故答案为Ag++Cl-=AgCl↓;Ba(NO3)2+2AgCl= BaCl2↓+2AgNO3;
II. (1)上述十种物质中有两种物质之间可发生离子反应:H++OH=H2O,说明是强酸强碱反应生成溶于水的盐的离子反应,氢氧化钡和稀硝酸反应符合,该离子反应对应的化学方程式为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
故答案为Ba(OH)2+2HNO3=Ba(NO3)2+2H2O;
(2)Al2(SO4)3属于盐是强电解质,水溶液中完全电离,电离方程式为:Al2(SO4)3= 2Al3++3SO42-,
故答案为Al2(SO4)3= 2Al3++3SO42-;
(3)少量的④通入⑥的溶液中反应,是二氧化碳通入氢氧化钡溶液中反应生成碳酸钡沉淀和水,反应的离子方程式为Ba2++2OH-+CO2=BaCO3↓+H2O过量的④通入⑥的溶液中反应的离子方程式为CO2 + OH-=HCO3-,
故答案为Ba2++2OH-+CO2=BaCO3↓+H2O;CO2 + OH-=HCO3-;
(4)⑥与过量的碳酸氢钠溶液反应生成碳酸钡、碳酸钠和水,离子反应为Ba2++2OH-+2HCO3- =2H2O + BaCO3↓+CO32-,
故答案为Ba2++2OH-+2HCO3- =2H2O + BaCO3↓+CO32- ;
(5)②与⑨发生反应的化学方程式为:Al+4HNO3=Al(NO3)3+NO↑+2H2O,双线桥法表示为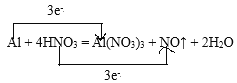 ,当有5.4gAl物质的量=
,当有5.4gAl物质的量=![]() =0.2mol,电子转移为0.2mol×(30)=0.6mol,电子数为0.6NA或3.612×1023,
=0.2mol,电子转移为0.2mol×(30)=0.6mol,电子数为0.6NA或3.612×1023,
故答案为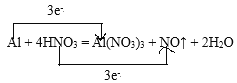 ;0.6NA或3.612×1023。
;0.6NA或3.612×1023。


科目:高中化学 来源: 题型:
【题目】将 51.2g Cu 完全溶于适量浓硝酸中,收集到氮的氧化物(含 NO、N2O4、NO2)的混合物共 0.8mol, 这些气体恰好能被 600mL 2 mol·L—1NaOH 溶液完全吸收,生成含 NaNO3 和NaNO2 的盐溶液,其中 NaNO3 的物质的量为( )
A. 0.2mol B. 0.4mol C. 0.6mol D. 0.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:AlO+HCO+H2O=Al(OH)3↓+CO![]() ,向含0.01 mol NaAlO2和0.02mol NaOH的稀溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,下列对应关系正确的是( )
,向含0.01 mol NaAlO2和0.02mol NaOH的稀溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2—)>c(OH) |
B | 0.01 | c(CO32—)+c(HCO3—)+c(H2CO3)=c(AlO2—) |
C | 0.015 | c(Na+)>c(CO32—)>c(OH)>c(HCO3—) |
D | 0.03 | c(Na+)+c(H+)=c(CO32—)+c(HCO3—)+c(OH) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为淡黄色固体,R和T是两种生活中常见的金属单质,C、F是无色无味的气体。
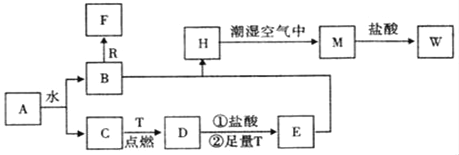
(1)物质A的化学式为_____,D化学式为_____,W的化学式为_____;
(2)B与R反应生成F的离子反应式为___________;
(3)A与CO2反应的化学反应方程式为____________;
(4)H转化为M的化学反应方程式为_____________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是重要的资源,可以制备一系列物质,
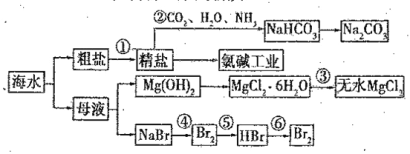
下列说法正确的是( )
A.步骤②中,应先通CO2 ,再通NH3
B.步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水
C.步骤④、⑤、⑥反应中,溴元素均被氧化
D.除去粗盐中的 SO42-、Ca2+ 、Mg2+ 等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2 溶液→Na2CO3 溶液→过滤→盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下面的方案进行某些离子的检验,其中方案设计严密的是( )
A.检验试液中的SO42-:试液![]() 无沉淀
无沉淀![]() 白色沉淀
白色沉淀
B.检验试液中的Fe2+:试液![]() 无明显现象
无明显现象![]() 红色溶液
红色溶液
C.检验试液中的I-:试液![]() 棕黄色溶液
棕黄色溶液![]() 蓝色溶液
蓝色溶液
D.检验试液中的CO32-:试液![]() 白色沉淀
白色沉淀![]() 沉淀溶解
沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物燃料电池(BFC)是以有机物为燃料,直接或间接利用酶作为催化剂的一类特殊的燃料电池,其能量转化效率高,是一种真正意义上的绿色电池,其工作原理如图所示。
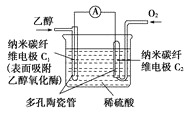
已知C1极的电极反应式为:C2H5OH+3H2O-12e-=2CO2+12H+,下列有关说法不正确的是( )
A. C1极为电池负极,C2极为电池正极
B. 电子由C2极经外电路导线流向C1极
C. C2极的电极反应式为O2+4H++4e-=2H2O
D. 该生物燃料电池的总反应式为:C2H5OH+3O2=2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有NaCl、Na2SO4和NaNO3的混合溶液,选择适当的试剂将其转化为相应的沉淀或固体,从而实现Cl-、SO42-和NO3-的分离,实验过程如图所示:
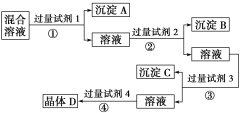
请回答下列问题:
(1)写出上述实验过程中所用试剂的名称:
试剂1__,试剂2__,试剂4___。
(2)加入过量试剂3的目的是___。
(3)在加入试剂4后,获得晶体D的实验操作④是___。
(4)写出过程②的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe(OH)3胶体可使水中悬浮物凝聚沉淀,是城市饮用水处理新技术。
(1)实验室制取Fe(OH)3胶体的操作是往____(填序号)中逐滴加入___(填序号),继续煮沸至出现红褐色即停止加热。
①沸水 ②NaOH溶液 ③饱和FeCl3溶液
(2)相应的化学方程式是____。
(3)向Fe(OH)3胶体中逐滴加入硅酸胶体,逐渐出现红褐色沉淀,出现该现象的原因是___。
(4)除去胶体中混有的FeCl3和HCl的方法是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com