
有关叙述:能说明M比N的非金属性强的叙述是
①非金属单质M能从N的化合物中置换出非金属单质N。
②M原子比N原子容易得到电子。
③单质M跟H2反应比N跟H2反应容易得多。
④气态氢化物水溶液的酸性HmM>HnN。
⑤最高价氧化物对应水化物的酸性HmMOx>HnNOy。
⑥熔点M>N。
| A.①②③⑤ | B.②⑤ |
| C.①②③④⑤ | D.全部 |
A
解析试题分析:判断非金属性强弱可以从以下几个方面去判断;1、根据形成的氢化物的稳定性或还原性:越稳定或还原性越弱,则其对应元素的非金属越强。 2、根据非金属单质与H2化合的难易程度:越易化合则非金属性越强。3、与盐溶液之间的置换反应。非金属性强的单质能置换出非金属性弱的单质。4、最高价氧化物对应水化物的酸性强弱(F除外)。酸性越强,对应元素的非金属性越强。 5、同周期中,从左向右,随核电荷数的增加,非金属性增强。同主族中,从上到下,随核电荷数的增加,非金属性减弱。6、非金属的简单阴离子还原性的强弱。阴离子还原性越强,对应非金属单质的氧化性越弱。7、与同一可变价金属反应,生成物中金属元素价态的高低。金属元素在该产物中价态越高,则说明该非金属元素的非金属性越强。例:2Cu+S==Cu2S Cu+Cl2==CuCl2 所以,Cl的非金属性强于S。 8、根据原子结构:原子半径(电子层数)越小,最外层电子数越多,非金属性越强,反之越弱。 9、几种非金属同处于一种物质中,可用其化合价判断非金属性的强弱 如HClO、HClO3中,氯元素显正价、氧元素显负价,说明氧的非金属性强于氯。
10、能量:非金属元素原子得电子放热,放热越多离子越稳定,非金属越强。 因此答案选A
考点:考查非金属性强弱的判断方法


科目:高中化学 来源: 题型:单选题
下表为元素周期表前四周期的一部分,且X、Y、Z、R和W为主族元素。下列说法正确的是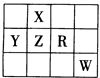
| A.五种元素可能都是金属元素 |
| B.五种元素的原子最外层电子数一定都大于2 |
| C.X的氢化物的沸点一定比Z的氢化物的沸点高 |
| D.R的最高价氧化物对应的水化物一定是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素X、Y、Z在周期表中位置如图。下列说法正确的是( )
| A.若它们均为金属元素,则X与氧元素组成的物质有多种 |
| B.若它们的原子最外层电子数之和为11,则它们均为非金属元素 |
| C.Z单质一定不能置换出Y单质。 |
| D.Z元素的最高化合价一定等于Y元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
短周期元素甲,乙,丙,丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数和电子层数相等,则 ( )
| A.原子半径 丁 >丙>乙 |
| B.单质的还原性丁>丙>甲 |
| C.甲,乙,丙的氧化物均为共价化和物 |
| D.乙,丙,丁的最高价氧化物对应的水化物能相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为:HXO4>H2YO4>H3ZO4,则下列判断中正确的是( )
| A.元素非金属性按X、Y、Z的顺序减弱 |
| B.原子的电子能力按X、Y、Z的顺序增强 |
| C.气态氢化物的稳定性按X、Y、Z的顺序增强 |
| D.单质的氧化性按X、Y、Z的顺序增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有a、b、c、d四种金属,将a与b用导线连结起来浸入稀硫酸溶液中,b不被腐蚀。将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将Cu浸入b的盐溶液里,无明显变化。如果把Cu浸入c的盐溶液里,有c的单质析出。据此判断它们的活动性由强到弱的顺序是( )
| A.d>c>a>b | B.d>b>a>c | C.b>a>d>c | D.d>a>b>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com