
����Ŀ������������ѧ���㣬����̼�ṹ�����֣�����һ����-����̼Ӳ�ȳ������ʯ���壬��Ϊ����һָ�ij�Ӳ�²��ϣ���֪�õ���̼�Ķ�ά����ṹ��ͼ��ʾ�������йص���̼��˵������ȷ����
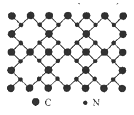
A. �þ����е�̼����ԭ�Ӻ��ⶼ����8�����ȶ��ṹ
B. ����̼��̼��+4�ۣ�����-3��
C. ÿ��̼ԭ�����ĸ���ԭ��������ÿ����ԭ�Ӻ�����̼ԭ������
D. ����̼�ķ���ʽΪC3N4
���𰸡�D
��������
A.����ͼ�нṹ��֪��ÿ��̼ԭ����Χ���ĸ����ۼ���ÿ����ԭ����Χ���������ۼ���̼ԭ���������4�����ӣ��γ��ĸ����۽����8�����ȶ��ṹ����ԭ���������5�����ӣ��γ��������ۼ���Ҳ��8�����ȶ��ṹ��A��ȷ��
B.����Ԫ�صķǽ�����N>C�������γɹ��ۼ�ʱ�����õ��Ӷ�ƫ��N��ƫ��C�����Ե���̼��̼��+4�ۣ�����-3�ۣ�B��ȷ��
C.���ݾ���ṹ��֪ÿ��̼ԭ�����ĸ���ԭ��������ÿ����ԭ�Ӻ�����̼ԭ��������C��ȷ��
D.���ڵ���̼��ԭ�Ӿ��壬�����ڷ��ӣ����û�з���ʽ��D����
�ʺ���ѡ����D��


 ѧϰʵ����ϵ�д�
ѧϰʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��֪����Ԫ�ص�ԭ�������Ĵ�С˳��Ϊ C>A>B>D>E��A��Cͬ���ڣ�B��C ͬ���壻A��B�γ����ӻ����![]() �����е����ӵĵ�������ͬ�� ���������Ϊ 30��D �� E ���γ� 5��10���ӵķ��ӡ��Իش��������⣺
�����е����ӵĵ�������ͬ�� ���������Ϊ 30��D �� E ���γ� 5��10���ӵķ��ӡ��Իش��������⣺
(1)д���������ʵĵ���ʽ��
![]() �ĵ���ʽ��____________________��A��B��E�γɵĻ����____________________��
�ĵ���ʽ��____________________��A��B��E�γɵĻ����____________________��
(2)A��B ��Ԫ����ɵĻ�����![]() ���ڵĻ�ѧ����__________________________________��
���ڵĻ�ѧ����__________________________________��
(3)д�� D �� E �γɵ� 5 �� 10 ���ӷ����������ĵ�һ����Ӧ�ķ���ʽ��___________________________________________________��
��.���������ʽ��з��ࣨ������ţ�����Ϊͬ�����������________________����Ϊͬ���칹�����________________����Ϊͬϵ�����________________.
��![]() ��
��![]() ����
����![]() ��
��![]() ����
����![]() ��
��![]() ���ܽ��ʯ��ˮ���� ��������������� ��
���ܽ��ʯ��ˮ���� ��������������� ��![]() ��
�� ![]() ��
��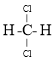
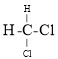 ����
����![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������������������ӦΪ 2NO2(g)��O3(g) ![]() N2O5(g)��O2(g)���й�˵����ȷ������������
N2O5(g)��O2(g)���й�˵����ȷ������������
A. ����ѹǿ������Ӧ���� B. �����¶ȿɼ�С��Ӧ����
C. �ﵽƽ��ʱ��v(��)��v(��)��0 D. �ﵽƽ��ʱ��NO2ת����Ϊ100%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ѧ֪ʶ�ش��������⣺
(1)������������Ar ��MgBr2 ��Na2O2 ��H2SO4 ��CS2 ��NH4Br ��BaO ��RbOH��
ֻ���ڹ��ۼ�����______ (����ţ���ͬ)��ֻ�������Ӽ�����_____���ȴ������Ӽ��ִ��ڼ��Թ��ۼ�����_____���ȴ������Ӽ��ִ��ڷǼ��Թ��ۼ�����_____��
(2)��д���������ʵĵ���ʽ��
CO2______�� Na2O2______��
(3)���õ���ʽ��ʾNaCl���γɹ���____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����VA��Ԫ�ص�ԭ��(��R��ʾ)��Aԭ�ӽ���γ�RA3��̬���ӣ���ռ乹�ͳ������Ρ�PCl5����̬��Һ̬ʱ�����ӽṹ����ͼ��ʾ�����й���PCl5���ӵ�˵���в���ȷ����( )
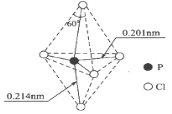
A. ÿ��ԭ�Ӷ��ﵽ8�����ȶ��ṹ����Ϊ�Ǽ��Է���
B. ����(��Cl��P��Cl)��120����90����180������
C. PCl5���Ⱥ��ֽ����ɷ��ӿռ乹�ͳ������ε�PCl3
D. ������5��P��Cl�����ܲ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֻ�������ԭ�ϣ������ö��ַ����ϳɡ�
(1)��CO2�����״���
��֪����CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(l)��H=��akJmol��1��
CH3OH(g)+H2O(l)��H=��akJmol��1��
��2H2(g)+O2(g)�T2H2O(l)��H=��b kJmol��1�� (a��b��>0)
���ʾCH3OH(g)ȼ�յ��Ȼ�ѧ����ʽΪ��____________��
Ҫʹ��Ӧ����һ�������½�����ƽ�������ƶ����ɲ�ȡ�Ĵ�ʩ��_______(��д��ĸ���)��
a����С��Ӧ�������ݻ�
b������Ӧ�������ݻ�
c�������¶�
d��ʹ�ú��ʵĴ���
e����ƽ����ϵ�м�ʱ�����CH3OH
(2)��CO�����״���
��֪��CO(g)+2H2(g) ![]() CH3OH(g)����ͼ�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߡ�
CH3OH(g)����ͼ�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߡ�

�ٸ÷�Ӧ���ʱ���H__________0(������������������������)��
��T1��T2�¶��µ�ƽ�ⳣ����С��ϵ��K1_______K2 (�� ����������������������)��
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���______________��
A�������¶�
B����CH3OH(g)����ϵ�з���
C��ʹ�ú��ʵĴ���
D������He��ʹ��ϵ��ѹǿ����
(3)CO2�ڹ�ҵ���ж�����;������֮һ�Ǻϳɵ�̼ϩ���������Ϊ1 L���ܱ������У�����1molCO2��2.5molH2��������Ӧ��2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)��H=-128kJ/mol������¶ȶԴ�����Ч�ʺ� CO2ƽ��ת���ʵ�Ӱ����ͼ��ʾ��
C2H4(g)+4H2O(g)��H=-128kJ/mol������¶ȶԴ�����Ч�ʺ� CO2ƽ��ת���ʵ�Ӱ����ͼ��ʾ��
��ͼ�е���ʱ�������¶����ߴ����Ĵ�Ч����ߣ���CO2��ƽ��ת����ȴ�������ͣ���ԭ����__________��
��250 ��ʱ���÷�Ӧ��ƽ�ⳣ��KֵΪ__________��
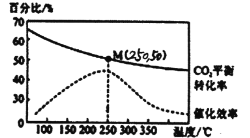
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ǿ����Դ���⣬�Ӻ�ˮ����ȡʳ�κ���Ĺ�����ͼ��ʾ����������������ǣ�

A. ������ˮ�ķ�����Ҫ�������������������ӽ�����
B. ��NaClΪԭ�Ͽ��������ռ��������ơ�����������Ȼ�����Ʒ
C. ������й����ȿ��������壬����Ϊ���������ܶȱȿ������ܶ�С
D. ��SO2ˮ��Һ����Br2�����ӷ�Ӧ����ʽΪ��Br2+SO2+2H2O�T4H++SO42��+2Br��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������A��B������̼���⡢���������Ⱦ�Ϊ6��1��4����ȫȼ��0.1 mol A������3.6 gˮ��Bֻ��һ��ȩ����1.1g B������������Һ��Ӧ��������2.7 g Ag�������й�������A������B���ж���ȷ����
A. ����Aһ������ȩ
B. ����A������B��Ϊͬ���칹��
C. ����B��ͬ���칹���мȺ���ȩ���ֺ����ǻ�����6��
D. ����B���������ͬ���칹����4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��A��B��C��D��E��ԭ����������������֪��
��C������������Ӧ��ˮ����������̬�⻯�ﷴӦ�������Σ�
��A�������������������Һ�壬A��Eͬ���壬C��B��D���ڣ�
��A��B��C��D����Ԫ�����һ�����ӻ�����F�������ԭ����֮��Ϊ5�U1�U1�U3��
��ش��������⣺
��1��C����̬�⻯��ĵ���ʽΪ___��A�����ڱ��е�λ��___��
��2��������E2D2�����������Ӹ�����Ϊ___��F���еĻ�ѧ������Ϊ___��
��3��F��Һ������EDA��ϡ��Һ��ϣ������ӷ���ʽΪ___��
��4��������C����̬�⻯�������а��̼�C2���ɣ�д���仯ѧ��Ӧ����ʽ___��
��5��C2A4����ȼ�ϵ����һ�ֻ����Ѻõļ���ȼ�ϵ�أ��������Һ��20%��30%KOH��Һ����ȼ�ϵ�صĸ�����ӦʽΪ___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com