
【题目】甲醇是一种基础化工原料,可以用多种方法合成。
(1)用CO2生产甲醇。
已知:①CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
CH3OH(g)+H2O(l)△H=﹣akJmol﹣1;
②2H2(g)+O2(g)═2H2O(l)△H=﹣b kJmol﹣1; (a、b均>0)
则表示CH3OH(g)燃烧的热化学方程式为:____________。
要使反应①在一定条件下建立的平衡逆向移动,可采取的措施有_______(填写字母序号)。
a.缩小反应容器的容积
b.扩大反应容器的容积
c.升高温度
d.使用合适的催化剂
e.从平衡体系中及时分离出CH3OH
(2)用CO生产甲醇。
已知:CO(g)+2H2(g) ![]() CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g),如图是该反应在不同温度下CO的转化率随时间变化的曲线。

①该反应的焓变ΔH__________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数大小关系是K1_______K2 (填 “>”、“<”或“=”)。
③若容器容积不变,下列措施可增加甲醇产率的是______________。
A.升高温度
B.将CH3OH(g)从体系中分离
C.使用合适的催化剂
D.充入He,使体系总压强增大
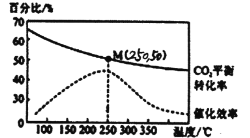
(3)CO2在工业上有多种用途,其中之一是合成低碳烯烃。在体积为1 L的密闭容器中,充入1molCO2和2.5molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H=-128kJ/mol,测得温度对催化剂催化效率和 CO2平衡转化率的影响如图所示:
C2H4(g)+4H2O(g)△H=-128kJ/mol,测得温度对催化剂催化效率和 CO2平衡转化率的影响如图所示:
①图中低温时,随着温度升高催化剂的催化效率提高,但CO2的平衡转化率却反而降低,其原因是__________。
②250 ℃时,该反应的平衡常数K值为__________。
【答案】2CH3OH(g)+3O2(g) =2CO2 (g)+4H2O(l) ΔH =+(2a -3b)kJ·mol-1 bc < > B △H<0,温度升高,平衡向逆反应方向移动,所以CO2的平衡转化率降低 1
【解析】
(1)根据盖斯定律分析书写CH3OH(g)燃烧的热化学方程式;对于反应①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l)△H=-akJmol-1,正反应为气体体积减小的放热反应,根据平衡移动的原理分析解答;
CH3OH(g)+H2O(l)△H=-akJmol-1,正反应为气体体积减小的放热反应,根据平衡移动的原理分析解答;
(2)①由达到平衡所需要的时间长短知,T1<T2,据此分析判断;②正反应是放热反应,根据温度对平衡移动的影响分析解答;③CO(g)+2H2(g) ![]() CH3OH(g) △H<0,结合平衡移动的影响因素分析解答;
CH3OH(g) △H<0,结合平衡移动的影响因素分析解答;
(3)①2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H=-128kJ/mol,根据温度对平衡移动的影响分析解答;②根据三段式分析解答。
C2H4(g)+4H2O(g)△H=-128kJ/mol,根据温度对平衡移动的影响分析解答;②根据三段式分析解答。
(1)①CO2(g)+3H2(g)═CH3OH(g)+H2O(l) △H=-akJmol-1,②2H2(g)+O2(g)═2H2O(l) △H=-bkJmol-1;根据盖斯定律,将3×②-2×①得:2CH3OH(g)+3O2(g) = 2CO2(g)+4H2O(l) △H=+(2a-3b)kJmol-1,所以CH3OH(g)燃烧的热化学方程式为:2CH3OH(g)+3O2(g) = 2CO2(g)+4H2O(l) △H=+(2a-3b)kJmol-1;对于反应①CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) △H=-akJmol-1,正反应为气体体积减小的放热反应。a.正反应为气体体积减小的反应,缩小反应容器的容积,压强增大,平衡正向移动,故a错误;b.正反应为气体体积减小的反应,扩大反应容器的容积,压强减小,平衡逆向移动,故b正确;c.正反应为放热反应,升高温度,平衡逆向移动,故c正确;d.使用合适的催化剂,可以加快反应速率,但不影响平衡移动,故d错误;e.从平衡体系中及时分离出CH3OH,生成物浓度减小,平衡正向移动,故e错误;故选bc,故答案为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H=+(2a-3b)kJmol-1;bc;
CH3OH(g)+H2O(l) △H=-akJmol-1,正反应为气体体积减小的放热反应。a.正反应为气体体积减小的反应,缩小反应容器的容积,压强增大,平衡正向移动,故a错误;b.正反应为气体体积减小的反应,扩大反应容器的容积,压强减小,平衡逆向移动,故b正确;c.正反应为放热反应,升高温度,平衡逆向移动,故c正确;d.使用合适的催化剂,可以加快反应速率,但不影响平衡移动,故d错误;e.从平衡体系中及时分离出CH3OH,生成物浓度减小,平衡正向移动,故e错误;故选bc,故答案为:2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) △H=+(2a-3b)kJmol-1;bc;
(2)①由达到平衡所需要的时间长短知,T1<T2,当温度由T2→T1(降温)时,CO的转化率增大,说明降低温度,平衡向右移动,故正反应是放热反应,△H<0,故答案为:<;
②正反应是放热反应,升高温度,平衡逆向移动,K减小,所以K1>K2,故答案为:>;
③CO(g)+2H2(g) ![]() CH3OH(g) △H<0。A.升高温度,平衡逆向移动,所以甲醇产率降低,故错误;B.将CH3OH(g)从体系中分离,平衡正向移动,甲醇产率增大,故正确;C.使用合适的催化剂平衡不移动,甲醇产率不变,故错误;D.充入He,使体系总压强增大,各组分的浓度不变,平衡不移动,甲醇产率不变,故错误;故选B;
CH3OH(g) △H<0。A.升高温度,平衡逆向移动,所以甲醇产率降低,故错误;B.将CH3OH(g)从体系中分离,平衡正向移动,甲醇产率增大,故正确;C.使用合适的催化剂平衡不移动,甲醇产率不变,故错误;D.充入He,使体系总压强增大,各组分的浓度不变,平衡不移动,甲醇产率不变,故错误;故选B;
(3)①2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H=-128kJ/mol,温度升高,平衡向逆反应方向移动,所以CO2的平衡转化率降低,故答案为:△H<0,温度升高,平衡向逆反应方向移动,所以CO2的平衡转化率降低;
C2H4(g)+4H2O(g)△H=-128kJ/mol,温度升高,平衡向逆反应方向移动,所以CO2的平衡转化率降低,故答案为:△H<0,温度升高,平衡向逆反应方向移动,所以CO2的平衡转化率降低;
②在体积为1L的密闭容器中,充入1molCO2和2.5molH2,发生反应,250℃时,二氧化碳的平衡转化率50%,
2CO2(g)+6H2(g)C2H4(g)+4H2O(g)
起始量(mol/L) 1 2.5span> 0 0
变化量(mol/L) 0.51.5 0.25 1
平衡量(mol/L) 0.51 0.25 1
K=![]() =1,故答案为:1。
=1,故答案为:1。


科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图,下列说法正确的是( )

A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,通入HCl可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向体积为V L的恒容容器中加入0.3molA、0.1molC和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如下图所示。已知在反应过程中混合气体的总的物质的量没有变化。请回答:
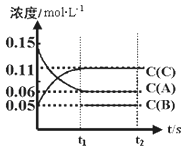
(1)V =_________。
(2)若t1=15s时,则0-t1阶段以C物质浓度变化表示的反应速率v(C)=__________。
(3)写出反应的化学方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知V是元素周期表中原子半径最小的原子。而W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。X 和 Ne 的核外电子数相差1,且 X和W能形成化合物X2W; 在Z所在的周期中,Z 元素的最高价氧化物的水化物酸性最强;四种元素的最外层电子数之和为18。 请回答下列问题:
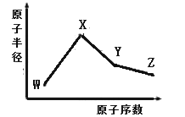
(1) Y元素位于元素周期表中位置为____________。
(2)已知U原子与V是同主族的短周期的元素,单核U、V离子具有相同的电子层结构,其离子的半径大小是:____________(写离子符号)
(3) Z的同族简单氢化物中,沸点最高的是________(写化学式),原因_______________________。
(4) W、X、Z 三种元素形成具有漂白性的化合物的电子式为___________;W的两种氢化物结构式分别为____________,______________。
(5) Y与Z形成的化合物YZ4在常温下是一种液态,它和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据量子力学计算,氮化碳结构有五种,其中一种β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示。下列有关氮化碳的说法不正确的是
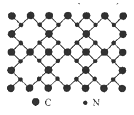
A. 该晶体中的碳、氮原子核外都满足8电子稳定结构
B. 氮化碳中碳显+4价,氮显-3价
C. 每个碳原子与四个氮原子相连,每个氮原子和三个碳原子相连
D. 氮化碳的分子式为C3N4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是:
A. 分子式为C7H8,分子中含有苯环的烃的一氯代物有4种
B. 硬脂酸与乙醇的酯化反应:C17H35COOH+C2H518OH![]() C17H35COOC2H5+H218O
C17H35COOC2H5+H218O
C. 如图所示实验可证明元素的非金属性:Cl>C>Si

D. C4H10的两种同分异构体因为分子间作用力大小不同,因而沸点正丁烷低于异丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】茶多酚具有抗氧化作用和抗衰老、降血脂等一系列很好的药理功能,其结构简式如下图,关于茶多酚的下列说法正确的数目有( )

①1mol茶多酚与浓溴水发生加成反应最多消耗6molBr2
②1mol茶多酚与足量的Na2CO3溶液反应放出4molCO2
③1mol茶多酚与足量的NaOH溶液反应最多消耗10molNaOH
④能发生氧化、取代、加成、缩聚反应
⑤已知茶多酚易溶于水,是因为能与水分子之间形成氢键
⑥能使酸性KMnO4溶液褪色
A. 2个B. 3个C. 4个D. 5个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2和NaClO2均具有漂白性,工业上用ClO2气体制NaClO2的工艺流程如图所示。
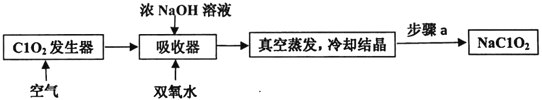
下列说法不正确的是
A. 步骤a的操作包括过滤、洗涤和干燥
B. 吸收器中生成NaClO2的离子方程式:2ClO2+H2O2=2C1O2-+O2↑+2H+
C. 工业上可将ClO2制成NaClO2固体,便于贮存和运输
D. 通入空气的目的是驱赶出ClO2,使其被吸收器充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体的说法中,正确的有( )
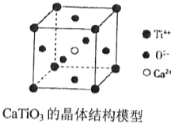
(图中Ca2+、O2-、Ti4+分别位于立方体的体心、面心和顶点)
①分子晶体中都存在共价键②在晶体中只要有阳离子就一定有阴离子③铯、钾、钠、钠-钾合金的熔点依次降低④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-相紧邻⑥12g石墨中含有的C-C键的个数为1.5NA(NA为阿伏加德罗常数)⑦晶体中分子间作用力越大,分子越稳定⑧离子晶体CaO的晶格能比KCl高,熔点KCl比CaO低
A. 2种B. 3种C. 4种D. 5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com