
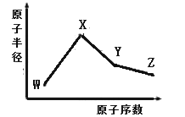
����Ŀ����֪V��Ԫ�����ڱ���ԭ�Ӱ뾶��С��ԭ�ӡ���W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯��ͼ��ʾ��X �� Ne �ĺ�����������1���� X��W���γɻ�����X2W�� ��Z���ڵ������У�Z Ԫ�ص�����������ˮ����������ǿ������Ԫ�ص�����������֮��Ϊ18�� ��ش��������⣺
(1) YԪ��λ��Ԫ�����ڱ���λ��Ϊ____________��
(2)��֪Uԭ����V��ͬ����Ķ����ڵ�Ԫ�أ�����U��V���Ӿ�����ͬ�ĵ��Ӳ�ṹ�������ӵİ뾶��С�ǣ�____________(д���ӷ���)
(3) Z��ͬ����⻯���У��е���ߵ���________(д��ѧʽ)��ԭ��_______________________��
(4) W��X��Z ����Ԫ���γɾ���Ư���ԵĻ�����ĵ���ʽΪ___________��W�������⻯��ṹʽ�ֱ�Ϊ____________��______________��
(5) Y��Z�γɵĻ�����YZ4�ڳ�������һ��Һ̬����������ˮ��Ӧ������һ�������һ��ǿ�ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ__________________________��
���𰸡���������IVA�� H-��Li+ HF HF����֮�������� ![]() H-O-H H-O-O-H SiCl4 + 3H2O = H2SiO3�� + 4HCl
H-O-H H-O-O-H SiCl4 + 3H2O = H2SiO3�� + 4HCl
��������
��֪V��Ԫ�����ڱ���ԭ�Ӱ뾶��С��ԭ�ӣ���H��W��X��Y��Z�����ֳ����Ķ�����Ԫ�أ�����ͼʾ�����ݰ뾶X��Y��Zλ��ͬһ���ڣ���X��Y��Z����Z���ڵ������У�Z Ԫ�ص�����������ˮ����������ǿ��ZΪCl�� X �� Ne �ĺ�����������1��XΪNa���� X��W���γɻ�����X2W����WΪO������Ԫ�ص�����������֮��Ϊ18��YΪSi��Ȼ�������
���ݷ�����֪��V��W��X��Y��Z�ֱ�ΪH��O��Na��Si��Cl��
(1) YԪ���ǹ裬λ��Ԫ�����ڱ���λ��Ϊ��������IVA�壻
(2) V��H�� Uԭ����V��ͬ����Ķ����ڵ�Ԫ�أ�����ΪLi��Na������U��V���Ӿ�����ͬ�ĵ��Ӳ�ṹ��UΪLi�������ӵİ뾶��С�ǣ�H-��Li+ ��
(3) Z��ͬ����⻯���У��е���ߵ���HF ��HF����֮����������
(4) W��X��Z ����Ԫ���γɾ���Ư���ԵĻ�����Ϊ�������ƣ����ĵ���ʽΪ![]() ��W�������⻯��ֱ�Ϊˮ�������⣬�ṹʽ�ֱ�ΪH-O-H�� H-O-O-H��
��W�������⻯��ֱ�Ϊˮ�������⣬�ṹʽ�ֱ�ΪH-O-H�� H-O-O-H��
(5) SiCl4�ڳ�������һ��Һ̬����������ˮ��Ӧ������Ԫ���غ㣬�ж�������Ϊ��������ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪSiCl4 + 3H2O = H2SiO3�� + 4HCl��


 ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼװ�ÿ���֤ͬ����Ԫ�طǽ����Եı仯���ɡ�
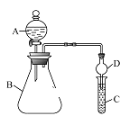
(1)����A������Ϊ_____������� D ������Ϊ_____��
(2)��Ҫ֤���ǽ����ԣ�Cl��I��C��Ϊ�������⻯�ػ����Һ��B ��װ��![]() ���壬�� A���Լ�Ϊ______���۲쵽 C ����Һ_____(������)���� ��֤�����ӻ��������Ĺ۵㿼�ǣ���װ��ȱ��β������װ�ã�����_________�� Һ����β����
���壬�� A���Լ�Ϊ______���۲쵽 C ����Һ_____(������)���� ��֤�����ӻ��������Ĺ۵㿼�ǣ���װ��ȱ��β������װ�ã�����_________�� Һ����β����
(3)��Ҫ֤���ǽ����ԣ�C��Si������ A�м����ᡢB �м�![]() ��C �м�
��C �м�![]() ��Һ���۲쵽 C ����Һ_____(������)������֤�������е�ͬѧ�� Ϊ������лӷ��ԣ�HCl�ɽ��� C �и���ʵ�飬Ӧ����װ�ü�����װ��__________________��Һ��ϴ��ƿ��ȥ��
��Һ���۲쵽 C ����Һ_____(������)������֤�������е�ͬѧ�� Ϊ������лӷ��ԣ�HCl�ɽ��� C �и���ʵ�飬Ӧ����װ�ü�����װ��__________________��Һ��ϴ��ƿ��ȥ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I�������г��˼������ʣ��ٽ��ʯ�롰����ϩ��C60����D2O��H2O����16O��18O����������������� ��
�� ����CH3CH2CH2CH3��
����CH3CH2CH2CH3��![]() ����CH4��CH3CH2CH3����CH3CH3��
����CH4��CH3CH2CH3����CH3CH3��![]() ��
��
���л�Ϊͬλ�ص���______����Ϊͬ�����������_____������ͬϵ�����_____����Ϊͬ���칹��______��
II��д�������л����ϵͳ������ṹ��ʽ��
��1��(CH3)2CH(CH2)2CH(C2H5)(CH2)2CH3_______��
��2��  _______��
_______��
��3�� _____��
_____��
��4��2-��-2-��ϩ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�������߱�ʾ��ͬ�¶���ˮ�����ӻ�����������˵������ȷ����
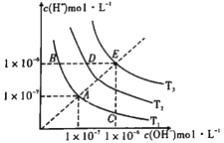
A. ͼ���¶�:T3>T2>T1
B. ͼ��pH��ϵ��:pH(B)=pH(D)=pH(E)
C. ͼ�����Kw��Ĺ�ϵ:E>D>A=B=C
D. C������������Ե�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ѧ֪ʶ�ش��������⣺
(1)������������Ar ��MgBr2 ��Na2O2 ��H2SO4 ��CS2 ��NH4Br ��BaO ��RbOH��
ֻ���ڹ��ۼ�����______ (����ţ���ͬ)��ֻ�������Ӽ�����_____���ȴ������Ӽ��ִ��ڼ��Թ��ۼ�����_____���ȴ������Ӽ��ִ��ڷǼ��Թ��ۼ�����_____��
(2)��д���������ʵĵ���ʽ��
CO2______�� Na2O2______��
(3)���õ���ʽ��ʾNaCl���γɹ���____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѡ�����л���DBP��������ά����֬�;�����ϩ�����ܼ����ر�������������ά��Ϳ�ϡ������������ܽ��ԡ���ɢ�Ժ�ճ���ԡ����л���A���ڶ��ױ�Ϊԭ�Ͽ��Ժϳ�DBP��
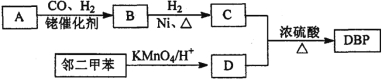
����A���л��ϳɵ���Ҫԭ�ϡ�A������ͼ���m/zΪ42��������ױ��������к���̼̼˫����B�ܷ���������Ӧ���л���C�ĺ˴Ź���������ʾ������к���5�ֻ�ѧ������ͬ����ԭ�ӣ��Ҹ���֮��Ϊ3��2��2��2��l��
�ش��������⣺
��1��A�Ľṹ��ʽΪ________��A��һ�����������ɾۺ���Ļ�ѧ����ʽΪ_______________��
��2��D�еĺ�����������___________���л���D�������л���C��Ӧ����DBP�Ļ�ѧ����ʽ��____________________________________________��
��3������˵����ȷ����___________ ��ѡ�������ĸ����
A��A�ܷ����ۺϷ�Ӧ���ӳɷ�Ӧ��������Ӧ
B����C��Ϊͬ���칹�壬�Һ�����ͬ�����ŵ���������2��
C���ڶ��ױ�����������D˵���л�������л���֮�����Ӱ��
D��1 mol DBP���뺬4mol NaOH����Һ��ȫ��Ӧ
��4����ҵ�ϳ����л���E��C8H4O3������D����DBP����Ӧ��Ϊ�������У�
i��E+C![]() ���� ii������+C
���� ii������+C ![]() DBP+H2O
DBP+H2O
����²�E�Ľṹ��ʽ___________��[
����ҵ�������л���E�ķ�Ӧ���£�2X+9O2![]() 2E+4CO2+4H2O��������X��һ�����ֻ�����֡�X�Ľṹ��ʽ��________��
2E+4CO2+4H2O��������X��һ�����ֻ�����֡�X�Ľṹ��ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ�ֻ�������ԭ�ϣ������ö��ַ����ϳɡ�
(1)��CO2�����״���
��֪����CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(l)��H=��akJmol��1��
CH3OH(g)+H2O(l)��H=��akJmol��1��
��2H2(g)+O2(g)�T2H2O(l)��H=��b kJmol��1�� (a��b��>0)
���ʾCH3OH(g)ȼ�յ��Ȼ�ѧ����ʽΪ��____________��
Ҫʹ��Ӧ����һ�������½�����ƽ�������ƶ����ɲ�ȡ�Ĵ�ʩ��_______(��д��ĸ���)��
a����С��Ӧ�������ݻ�
b������Ӧ�������ݻ�
c�������¶�
d��ʹ�ú��ʵĴ���
e����ƽ����ϵ�м�ʱ�����CH3OH
(2)��CO�����״���
��֪��CO(g)+2H2(g) ![]() CH3OH(g)����ͼ�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߡ�
CH3OH(g)����ͼ�Ǹ÷�Ӧ�ڲ�ͬ�¶���CO��ת������ʱ��仯�����ߡ�

�ٸ÷�Ӧ���ʱ���H__________0(������������������������)��
��T1��T2�¶��µ�ƽ�ⳣ����С��ϵ��K1_______K2 (�� ����������������������)��
���������ݻ����䣬���д�ʩ�����Ӽ״����ʵ���______________��
A�������¶�
B����CH3OH(g)����ϵ�з���
C��ʹ�ú��ʵĴ���
D������He��ʹ��ϵ��ѹǿ����
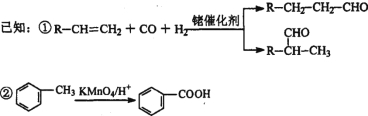
(3)CO2�ڹ�ҵ���ж�����;������֮һ�Ǻϳɵ�̼ϩ���������Ϊ1 L���ܱ������У�����1molCO2��2.5molH2��������Ӧ��2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)��H=-128kJ/mol������¶ȶԴ�����Ч�ʺ� CO2ƽ��ת���ʵ�Ӱ����ͼ��ʾ��
C2H4(g)+4H2O(g)��H=-128kJ/mol������¶ȶԴ�����Ч�ʺ� CO2ƽ��ת���ʵ�Ӱ����ͼ��ʾ��
��ͼ�е���ʱ�������¶����ߴ����Ĵ�Ч����ߣ���CO2��ƽ��ת����ȴ�������ͣ���ԭ����__________��
��250 ��ʱ���÷�Ӧ��ƽ�ⳣ��KֵΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȼ�ϵ����һ�־���Ӧ��ǰ������ɫ��Դ����ͼΪȼ�ϵ�صĽṹʾ��ͼ���������ҺΪNaOH��Һ���缫����Ϊ���ɶ��ʯī������ش���������:
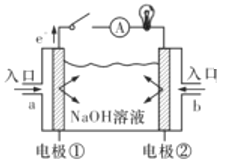
(1)����ȼ�ϵ��Ϊ����ȼ�ϵ�ء�
��a��ͨ�������Ϊ_____(����������)���������Һ�е�OH������______��(�����������)��
��д��������ȼ�ϵ�ع���ʱ�������ĵ缫��Ӧʽ��______________��
(2)����ȼ�ϵ��Ϊ����ȼ�ϵ�ء���֪��ص��ܷ�ӦΪCH4+2O2+2OH-=CO32-+3H2O
�������й�˵����ȷ����___________(����ĸ����)��
A.ȼ�ϵ�ؽ�����ת��Ϊ��ѧ��
B.�����ĵ缫��ӦʽΪCH4+10OH--8e-=CO32-+7H2O
C.�����ĵ缫��ӦʽΪO2+4H++4e-=2H2O
D.ͨ�����ĵ缫������ԭ��Ӧ
�ڵ����ļ���33.6L(��״����)ʱ�������ص�����ת��Ч��Ϊ80����������ת�Ƶĵ��ӵ����ʵ���Ϊ______mol.
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������һ�����Ƴ���������ҩ����ɰ�����(![]() )�ͼ״���Ӧ�Ƶã����������գ�
)�ͼ״���Ӧ�Ƶã����������գ�
��1��д������������Ľṹ��ʽ��________��
��2��A�DZ�![]() ������̼ԭ���ұ�����ֻ��һ��ȡ������һ��ͬϵ���A������̼ԭ�ӿ��Դ���ͬһƽ���ϣ�д��A�Ľṹ��ʽ____________��
������̼ԭ���ұ�����ֻ��һ��ȡ������һ��ͬϵ���A������̼ԭ�ӿ��Դ���ͬһƽ���ϣ�д��A�Ľṹ��ʽ____________��
��3��![]() �ǰ����������ij��ͬ���칹���һ�ȴ��������������������Һ���ȣ����ɵ��л�����Ľṹ��ʽΪ_____________��_______________��
�ǰ����������ij��ͬ���칹���һ�ȴ��������������������Һ���ȣ����ɵ��л�����Ľṹ��ʽΪ_____________��_______________��
��4����ҵ����![]() �����IJ���ͬ���͵ķ�Ӧ�Ƶð����ᡣ
�����IJ���ͬ���͵ķ�Ӧ�Ƶð����ᡣ
���밴ʵ�ʽ��еķ�Ӧ˳��д��ָ����Ӧ����������Ҫ���Լ��ͷ�Ӧ������
��һ��_________________���ڶ���________________��
��д�����IJ���Ӧ�Ļ�ѧ����ʽ��________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com