
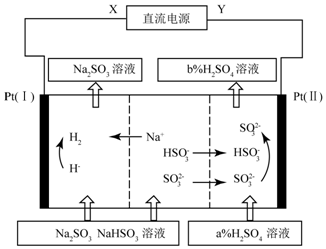
| A�� | XΪֱ����Դ��������YΪֱ�������ĸ��� | |
| B�� | ͼ�е�b��a | |
| C�� | P��I��������Һ��pH��С��Pt��II��������Һ��pH���� | |
| D�� | ��������Ϊ��Pt��I��H+�ŵ磬���¡�HSO3-?SO2-+H+��ƽ������ |
���� A�����ݵ������Һ���������ӵ��ƶ�����ȷ����Դ����������
B������Sԭ���غ��ж�a��b��С��
C������Pt����Ϊ������Pt����Ϊ�����ĵ缫��Ӧʽ�жϣ�
D��Pt��I��Ϊ�����������������ӵõ��ӷų��������缫��Ӧ����ʽΪ��2H++2e-=H2�����¡�HSO3-?SO2-+H+��ƽ�����ƣ�
��� �⣺A�������������ӵ��ƶ�����֪����������Pt���缫�ƶ�����������Pt�����ƶ������Pt����Ϊ������Pt����Ϊ����������XΪֱ����Դ�ĸ�����YΪֱ����Դ����������A����
B���������У������������в����м����ϡ���ỹ������������ӱ��������ɵ����ᣬ����b��a����B����
C��Pt����Ϊ�����������������ӵõ��ӷų��������缫��Ӧ����ʽΪ��2H++2e-=H2������P��I��������Һ��pH����Pt����Ϊ����������������������Ӻ��������������ʧ���ӣ��缫��Ӧ����ʽΪ��HSO3-+H2O-2e-=SO42-+3H+��SO32-+H2O-2e-=SO42-+2H+������Pt��II��������Һ��pH��С����C����
D��Pt��I��Ϊ�����������������ӵõ��ӷų��������缫��Ӧ����ʽΪ��2H++2e-=H2�����¡�HSO3-?SO32-+H+��ƽ�����ƣ���D��ȷ��
��ѡD��
���� ���⿼��ѧ�����صĹ���ԭ��������ȷ����ͼƬ�ǽⱾ��Ĺؼ���ע��ͼƬ�м������ʺ��������ʵı仯��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
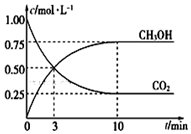 �����ִ���ҵ����������H2��CO��Ӧ������ȼ�ϼ״����䷴Ӧ����ʽ���£�CO2 ��g��+3H2��g��?H2O��l��+CH3OH��g����H=-49.00kJ•mol-1
�����ִ���ҵ����������H2��CO��Ӧ������ȼ�ϼ״����䷴Ӧ����ʽ���£�CO2 ��g��+3H2��g��?H2O��l��+CH3OH��g����H=-49.00kJ•mol-1�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ֱ�ͬʱ�����Ũ�ȵ����ᣬ�ų�����NaHCO3��Na2CO3�� | |
| B�� | ���ȶ���Na2CO3��NaHCO3 | |
| C�� | ����ʱˮ����Na2CO3��NaHCO3 | |
| D�� | ��Է�������Na2CO3��NaHCO3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ﵽƽ��ʱ��X��Y ��Ũ����� | |
| B�� | �����������Ϊ20 L��Z��ƽ��Ũ�ȱ�Ϊԭ����$\frac{1}{2}$ | |
| C�� | ��XŨ�ȱ仯��ʾ�ķ�Ӧ����Ϊ0.01 mol/��L•s�� | |
| D�� | �������¶�Y��ת���ʼ�С��������ӦΪ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
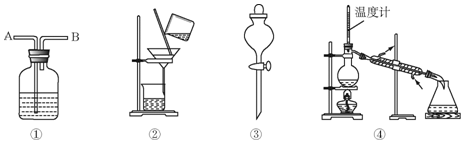
| ѡ�� | ���� | �Լ� | װ�� |
| A | C2H6��C2H4�� | �� | �� |
| B | �������ӣ� | �� | �� |
| C | ���������ᣩ | �� | �� |
| D | �ױ������ױ��� | �� | �� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ƭ��ʯī����ϡ���� | B�� | ͭƬ��ʯī������������Һ | ||
| C�� | пƬ��ͭƬ��ϡ���� | D�� | ͭƬ����Ƭ��CuSO4��Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com