
分析 (1)0.01mol/L的盐酸中水电离的H+的浓度和水电离出氢氧离子浓度相等,抓住这一点结合Kw=c(H+)×c(OH-)来解题;
(2)酸溶液混合,先计算混合后溶液中氢离子的物质的量,再根据c=$\frac{n}{V}$计算氢离子的物质的量浓度,最后根据pH=-lgc(H+)计算出混合液的pH.
解答 解:(1)0.01mol/L的盐酸中水电离的H+的浓度和水电离出氢氧离子浓度相等,Kw=c(H+)×c(OH-),水电离的c(H+)=10-12mol/L,故答案为:10-12mol/L;
(2)pH=1的盐酸和pH=4的盐酸等体积混合后,设体积均为VL,混合液中氢离子的物质的量为:n(H+)=VL×10-1mol/L+VL×10-4mol/L≈10-1Vmol,则混合溶液中氢离子浓度为:c(H+)=$\frac{0.1V}{2V}$=0.05mol/L,所以pH=2-lg5,故答案为:2-lg5.
点评 本题考查溶液PH的计算,和水的电离,学生只要认真分析,抓住水最离出的氢离子和氢氧根离子相等即可.


科目:高中化学 来源: 题型:选择题
| A. | 镀锌铁片比镀锡铁片更耐腐蚀 | |
| B. | 远洋海轮的尾部装上一定数量的锌板 | |
| C. | 用锌与硫酸制氢气时,往硫酸中滴少量硫酸铜 | |
| D. | 常温条件下,在空气中铝不易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
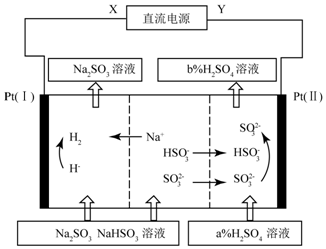
| A. | X为直流电源的正极,Y为直流电流的负极 | |
| B. | 图中的b<a | |
| C. | P(I)附近溶液的pH减小,Pt(II)附近溶液的pH增大 | |
| D. | 再生机理为:Pt(I)H+放电,导致“HSO3-?SO2-+H+”平衡右移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌为电池负极,发生氧化反应 | |
| B. | 电池工作时,氧气与锌直接化合,生成氧化锌 | |
| C. | 正极发生的反应是:$\frac{1}{2}$O2+2e-+2H+═H2O | |
| D. | 负极发生的反应是:Zn-2e-+H2O═ZnO+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油是各种液态烃的混合物 | |
| B. | 常压分馏的原料是重油 | |
| C. | 由分馏塔分馏出的各馏分均是混合物 | |
| D. | 减压分馏的主要产品有汽油、润滑油、煤油和沥青 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
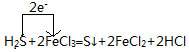 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
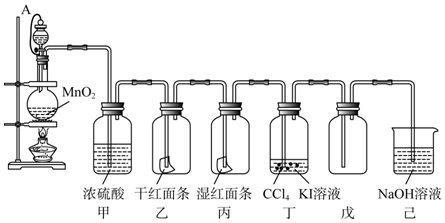
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 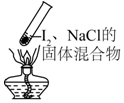 加热时,上部汇聚了固体碘,说明碘的热稳定性较差 | |
| B. | 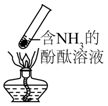 加热时,中部溶液变红,冷却后又变为无色 | |
| C. | 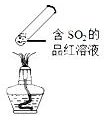 加热时,中部溶液变红,冷却后又变为无色 | |
| D. |  \加热时,上部汇聚了白色固体,说明氯化铵易升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28 g氮气含有的原子数为NA | |
| B. | 标准状况下,22.4 L水中含有的水分子数为NA | |
| C. | 1 molOH-含有的电子数为10NA | |
| D. | 0.1 L 1 mol•L-1NaCl溶液中含有Na+个数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com