
| A、由水电离的c(H+)=1×10-12mol/L的溶液中:Ca2+、K+、Cl-、HCO3- |
| B、使甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ |
| C、pH=10的溶液中:Na+、Cl-、SO42-、NO3- |
| D、含有CO32-的溶液中:K+、C6H5OH、Cl2、SO42- |


科目:高中化学 来源: 题型:
| A、在使用过程中,电池负极区溶液的pH减小 |
| B、使用过程中,电子由Ag20极经外电路流向Zn极 |
| C、Zn是正极,Ag2O是负极 |
| D、Zn电极发生还原反应,Ag2O电极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纸上层析法通常以滤纸作为惰性支持物,滤纸纤维上的羟基具有亲水性,它所吸附的水作固定相 |
| B、用移液管取25.00mL液体于锥形瓶中时不得将移液管下端深入锥形瓶内 |
| C、实验中不慎将苯酚沾到皮肤上,应立即用酒精洗涤,再用水冲洗 |
| D、将3~4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、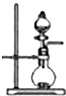 如图可用于实验室制取少量NH3或O2 |
B、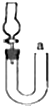 可用从a处加水的方法检验如图装置的气密性 |
C、 实验室可用如图的方法收集Cl2 |
D、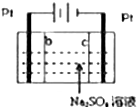 利用如图装置制硫酸和氢氧化钠,其中b为阴离子交换膜、c为阳离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 现象或反应 | 原理解释 | |
| A | 铝箔在酒精灯火焰上加热熔化但不滴落 | 铝箔表面生成的氧化物具有高熔点 |
| B | 钠和氧气在加热条件下进行反应 | 该反应为吸热反应 |
| C | 碳酸钠和氢氧化钠溶液中滴加酚酞,溶液都呈红色 | 碳酸钠和氢氧化钠都是碱 |
| D | 铁制容器可用于盛装冷的浓硫酸 | 铁与浓硫酸不反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、只生成CaHPO4溶液 |
| B、有Ca3(PO4)2和CaHPO4生成 |
| C、只生成Ca(H2PO4)2溶液 |
| D、有CaHPO4和Ca(H2PO4)2生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、苯和油脂能发生取代反应,不能发生氧化反应 |
| B、合成纤维、聚四氟乙烯都是高分子化合物 |
| C、乙酸、葡萄糖分子中都含羟基,都能与NaOH发生反应 |
| D、蛋白质溶液中滴入AgNO3溶液会析出沉淀,再加蒸馏水沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com