
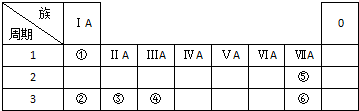
 下表列出了①~⑥六种元素在周期表中的位置.
下表列出了①~⑥六种元素在周期表中的位置.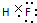 ,
, ;
;
| ||
| ||


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:

| A、当有0.2 mol电子转移时,a电极产生2.24 L H2 |
| B、b电极上发生的电极反应式为2H++2e-═H2↑ |
| C、d电极上发生的电极反应式为O2+4H++4e-═2H2O |
| D、d电极上进行氧化反应,B池中的H+可以通过隔膜进入A池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
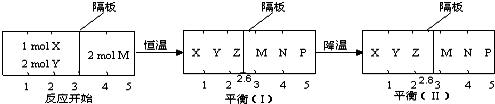
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| SO2 | O2 | SO2 | O2 | |||
| 1 | T1 | 4 | 2 | x | 0.8 | 6 |
| 2 | T2 | 4 | 2 | 0.4 | y | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
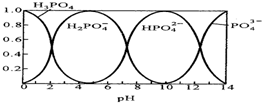 磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:
磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:| c(Na+) |
| c(PO43-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
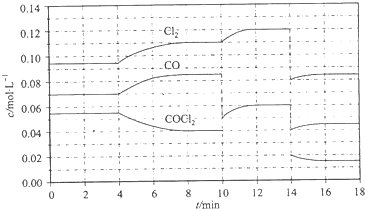 光气 (COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.
光气 (COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.5mol/(L?min) |
| B、0.15mol/(L?min) |
| C、0.75mol/(L?min) |
| D、0.075mol/(L?min) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com