
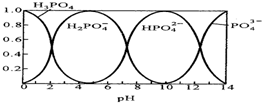
 磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:
磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:| c(Na+) |
| c(PO43-) |
| c(HPO42-).c(OH-) |
| c(PO43-) |
| c(Na+) |
| c(PO43-) |
| c(HPO42-).c(OH-) |
| c(PO43-) |
| 0.01×0.01 |
| 0.09 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
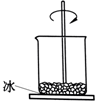 如图,小烧杯放在一块沾有水的玻璃片上,加入氯化铵固体与氢氧化钡晶体[Ba(OH)2?8H2O)],并用玻璃棒搅拌,玻璃片上的水结成了冰.由此可知( )
如图,小烧杯放在一块沾有水的玻璃片上,加入氯化铵固体与氢氧化钡晶体[Ba(OH)2?8H2O)],并用玻璃棒搅拌,玻璃片上的水结成了冰.由此可知( )| A、该反应中,化学能转变成热能 |
| B、反应物的总能量低于生成物的总能量 |
| C、氯化铵与氢氧化钡的反应为放热反应 |
| D、反应的热化学方程式为 2NH4Cl+Ba(OH)2→BaCl2+2NH3?H2O-Q |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 400 | 450 | 500 |
| 平衡常数K | a | 6a | 40a |


查看答案和解析>>
科目:高中化学 来源: 题型:
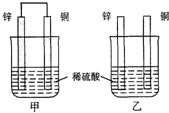 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.查看答案和解析>>
科目:高中化学 来源: 题型:
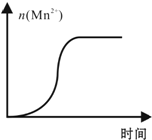 KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:| KMnO4酸性溶液浓度 (mol?L-1) | 溶液褪色所需时间(min) | ||
| 第一次 | 第二次 | 第三次 | |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/mol?L-1 | 体积(mL) | 浓度/mol?L-1 | 体积(mL) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
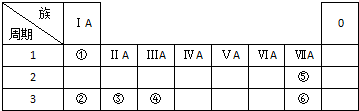 下表列出了①~⑥六种元素在周期表中的位置.
下表列出了①~⑥六种元素在周期表中的位置.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外活动小组用如图装置进行实验,试回答下列问题.
某课外活动小组用如图装置进行实验,试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2、H2、NH3的百分含量相等 |
| B、3v(N2)正=v(H2)逆 |
| C、定容容器中,气体的密度不变 |
| D、N2、H2、NH3的浓度之比为1:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com