


科目:高中化学 来源: 题型:
 有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体.
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体.查看答案和解析>>
科目:高中化学 来源: 题型:
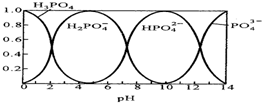 磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:
磷酸(H3PO4)在水溶液中各种存在形式物质的量分数δ随pH的变化曲线如图:| c(Na+) |
| c(PO43-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=7的氨水和氯化铵混合溶液中c(NH4+)=c(Cl-) |
B、浓度均为0.1mol?L-1的 溶液和CH3COONa溶液中,溶液中c( 溶液和CH3COONa溶液中,溶液中c( )<c(CH3COO-) )<c(CH3COO-) |
| C、pH=3的硫酸溶液和pH=11的氨水溶液等体积混合,混合后溶液显碱性 |
| D、已知酸性HF>CH3COOH,则等体积等物质的量浓度的NaF和CH3COONa溶液所含的阴离子数后者较多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com