
 有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体.
有A、B、C、D、E五种短周期元素,它们的原子序数依次增大,其中B是地壳中含量最多的元素.已知A、C及B、D分别是同主族元素,且B、D两元素原子核内质子数之和是A、C两元素原子核内质子数之和的2倍;在处于同周期的C、D、E三种元素中,E的原子半径最小;通常条件下,五种元素的单质中有三种气体,两种固体. ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
| A、用氨水溶解氯化银沉淀:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O |
| B、碱性条件下铝粉还原NaNO2:NO2-+2Al+3OH-+H2O=2AlO2-+NH3?H2O |
| C、硫酸氢铵溶液中滴加少量NaOH溶液:H++NH4++2OH-=NH3?H2O+H2O |
| D、二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
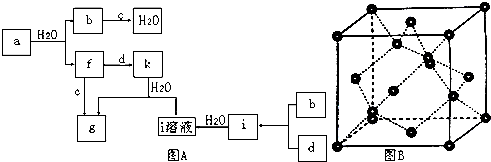
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(℃) | 400 | 450 | 500 |
| 平衡常数K | a | 6a | 40a |


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
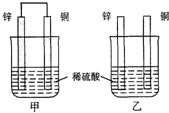 原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.
原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献.查看答案和解析>>
科目:高中化学 来源: 题型:
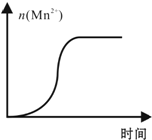 KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:
KMnO4酸性溶液与草酸(H2C2O4)溶液反应时,溶液紫色会逐渐褪去.某探究小组用测定此反应溶液紫色消失所需时间的方法,研究外界条件对反应速率的影响.该实验条件作如下限定:| KMnO4酸性溶液浓度 (mol?L-1) | 溶液褪色所需时间(min) | ||
| 第一次 | 第二次 | 第三次 | |
| 0.02 | 14 | 13 | 11 |
| 0.002 | 6.7 | 6.6 | 6.7 |
| KMnO4酸性溶液 | H2C2O4溶液 | ||
| 浓度/mol?L-1 | 体积(mL) | 浓度/mol?L-1 | 体积(mL) |
| 0.02 | 2 | b | 4 |
| a | 2 | c | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤⑥ | B、②③④⑤⑥ |
| C、②③④⑥⑦ | D、②③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com