
【题目】下列说法中正确的是
A.NO2、SO2、BF3分子中所有原子的最外层电子都满足了8e-稳定结构
B.P4和CH4都是正四面体分子且键角都为109o28ˊ
C.NaCl晶体中与每个Na+距离相等且最近的Na+共有12个
D.原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度
 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】从化学的规角分析,下列说法不正确的是
A.锂离子电池是一种生活中常用的化学电源
B.纳米材料可用于制造不用洗的衣服面料
C.水中加入“催化剂”,可变成汽车燃料“油”
D.科学家未研发出只加水就能跑的“水氢发动机”汽车
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验的反应原理用离子方程式表示正确的是( )
A.明矾净水:Al3++3H2O=Al(OH)3↓+3H+
B.用过量氨水吸收工业尾气中的SO2:2NH3?H2O+SO2=2NH4++SO32﹣+H2O
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2 ![]() Cu2++2C1﹣
Cu2++2C1﹣
D.用高锰酸钾标准溶液滴定草酸:2MnO4﹣+16H++5C2O42﹣=2Mn2++10CO2↑+8H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.4g铜与足量的浓硫酸在加热情况下充分反应,铜没有剩余.试计算:提示:(Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O)
CuSO4+SO2↑+2H2O)
(1)参加反应的硫酸的物质的量.
(2)生成的SO2的体积(标准状况下).
(3)将反应后的溶液用水稀释到100mL,计算硫酸铜溶液的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究Na2CO3和NaHCO3的性质,发现实验室里盛放两种固体的试剂瓶丢失了标签.于是,他们先对固体A、B进行鉴别,再通过实验进行性质探究.
(1)分别加热固体A、B,发现固体A受热产生的气体能使澄清石灰水变浑浊.A受热分解的化学方程式为 .
(2)称取两种固体各2g,分别加入两个小烧杯中,再各加10mL蒸馏水,振荡,测量温度变化;待固体充分溶解,恢复到室温,向所得溶液中各滴入2滴酚酞溶液. ①发现Na2CO3固体完全溶解,而NaHCO3固体有剩余,由此得出结论: .
②同学们在两烧杯中还观察到以下现象.其中,盛放Na2CO3的烧杯中出现的现象是(填字母序号).
a.溶液温度下降b.溶液温度升高c.滴入酚酞后呈浅红色d.滴入酚酞后呈红色
(3)如图所示,在气密性良好的装置Ⅰ和Ⅱ中分别放入药品,将气球内的固体同时倒入试管中. 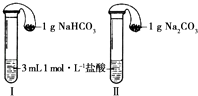
①两试管中均产生气体,(填“Ⅰ”或“Ⅱ”)的反应程度更为剧烈.
②反应结束后,气球均有膨胀,恢复至室温,下列说法正确的是(填字母序号).
a.装置Ⅰ的气球体积较大b.装置Ⅱ的气球体积较大
c.生成气体的体积根据盐酸计算d.生成气体的体积根据固体计算
(4)同学们将两种固体分别配制成0.5molL﹣1的溶液,设计如下方案并对反应现象做出预测:
实验方案 | 预测现象 | 预测依据 |
操作1:向2mL Na2CO3溶液中滴加1mL 0.5molL﹣1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32﹣浓度较大,能与CaCl2发生反应:(写离子方程式) |
操作2:向2mL NaHCO3溶液中滴加1mL 0.5molL﹣1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32﹣浓度很小,不能与CaCl2反应 |
实施实验后,发现操作2的现象与预测有差异:产生白色沉淀和气体,则该条件下,NaHCO3溶液与CaCl2溶液反应的离子方程式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把二氧化硫通入硝酸铁溶液中,溶液由黄色变为浅绿色,但立即又变为黄色,此时若滴入氯化钡溶液,则会产生白色沉淀。在上述一系列变化过程中,最终被还原的是
A. SO2 B. NO3- C. Fe3+ D. Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,几种弱酸的电离平衡常数如下:
弱酸 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)CH3COOH、H2CO3、H2SO3三种酸中酸性最弱的是__________(填化学式)。
(2)CH3COOH的电离平衡常数表达式为K=__________。
(3)写出H2CO3的第二步电离方程式:_____________。
(4)写出H2SO3溶液和CH3COONa溶液反应的离子方程式:____________________。
(5)将体积均为10mL、pH均为2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH的变化如图所示,则HX的电离平衡常数____________(填“大于”“ 小于”或“等于”)醋酸的电离平衡常数,理由是__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸是一种非常重要的化工原料,在工业上和实验室中有着广泛的应用.
(1)除铁锈(主要成分为Fe2O3),写出反应原理的离子方程式;
(2)制备硅胶,工业上可利用水玻璃和盐酸反应制备硅酸后,进一步处理可得到硅胶,写出水玻璃和盐酸反应的化学方程式;
(3)制氯气,实验室可以利用浓盐酸和高锰酸钾常温下反应来制取氯气, 反应同时还生成了MnCl2、KCl和H2O,写出该反应的化学方程式 , 在此反应中盐酸表现出了性.
(4)工业上可以利用如图所示装置制备盐酸,首先向(填A或B)管中通入氢气并点燃,然后再向(填A或B)管中通入氯气进行反应,此时火焰的颜色为 , 这样操作的理由是 . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
C. 第二阶段,Ni(CO)4分解率较低
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com