
【题目】某兴趣小组为探究![]() 和
和![]() 的性质,将两种气体同时通入水中,实验装置如图:
的性质,将两种气体同时通入水中,实验装置如图:
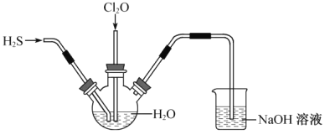
请回答:(1)三颈瓶中出现淡黄色沉淀,溶液呈强酸性,用一个化学方程式表示________。
(2)若通入水中的![]() 已过量,设计实验方案检验________。
已过量,设计实验方案检验________。
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】我国卫生部门制定的《关于宣传吸烟有毒与控制吸烟》的通知中规定:“中学生不准吸烟”。香烟燃烧产生的烟气中,有多种有害物质,其中尼古丁(C10H14N2)对人体危害最大,下列说法正确的是( )
A.尼古丁的摩尔质量是162g
B.尼古丁中C、H、O三种元素的质量比为10:14:2
C.尼古丁中氮元素的质量分数为17.3%
D.尼古丁是由26个原子构成的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,X和Z两元素的原子序数之和等于W元素的原子序数。下列说法正确的是( )
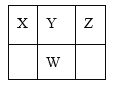
A.X、W分别与Y都能形成两种或两种以上的化合物,这些化合物都是酸性氧化物
B.X、Y、Z都能形成10电子的氢化物,其中Z的最简单氢化物沸点最高
C.X、Y、W与氢四种元素能组成离子化合物,该化合物一定能发生水解
D.X和W两元素的氧化物对应的水化物的酸性:X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将Fe2O3加入到HI溶液中:Fe2O3+6H+=2Fe3++3H2O
B.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++H2O=4Na++2Cu(OH)2↓+O2↑
C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S+2Cl-
D.已知电离平衡常数:H2CO3>HClO>HCO![]() ,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO
,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是( )

A. ①②③ B. ③②① C. ②①③ D. ①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用环己醇的氧化反应制备环己酮,反应原理和实验装置(部分夹持装置略去)如图:
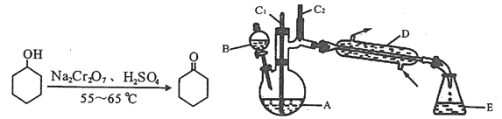
有关物质的物理性质见下表。
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.96 | 能溶于水和醚 |
环己酮 | 155.6(95.0)* | 0.95 | 微溶于水,能溶于醚 |
水 | 100.0 | 1.0 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点。
实验中通过装置B将酸性Na2Cr2O7溶液加到盛有10mL环己醇的A中,在55~60℃进行反应。反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮粗品和水的混合物。
(1)装置D的的名称是为__。
(2)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。
①如何滴加酸性Na2Cr2O7溶液___;
②蒸馏不能分离环己酮和水的原因是___。
(3)环己酮的提纯需要经过以下一系列的操作:
a.蒸馏、除去乙醚后,收集151~156℃馏分
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层
c.过滤
d.往液体中加入NaCl固体至饱和,静置,分液
e.加入无水MgSO4固体,除去有机物中少量的水
①上述提纯步骤的正确顺序是___;
②b中水层用乙醚萃取的目的是___;
③上述操作c、d中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需要的玻璃仪器有__,操作d中,加入NaCl固体的作用是__。
(4)恢复至室温时,分离得到纯产品体积为6mL,则环己酮的产率为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】妈妈教小鲁蒸馒头:先用酵头发面,面团发酵至两倍大后,再加纯碱调节酸性,然后将面团揉切后上锅蒸即可。小鲁查阅资料得知,酵头可使面团在微生物作用下产生CO2气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸。
(1)下列关于纯碱的认识正确的是___。
A.受热易分解 B.水溶液显碱性 C.属于碱 D.可与酸反应
(2)小鲁探究用Na2CO3调节面团酸度,而不用NaHCO3的原因。
①Na2CO3与NaHCO3质量均为1g时,消耗H+的物质的量更多的是___。
②以Na2CO3或NaHCO3为例,计算消耗H+的物质的量,写出计算过程。___
(3)小鲁实际操作时,发现面团发得不好,面团内的气孔少,略有酸味。妈妈指导小鲁将Na2CO3改用NaHCO3,继续揉面,上锅蒸后果然蒸出了松软的馒头。解释NaHCO3的作用___。
(4)某品牌复合膨松剂的说明书如图所示。

其中葡萄糖酸-δ-内酯和淀粉是助剂,其作用是防止膨松剂吸潮结块而失效。焦磷酸二氢二钠的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]化合物J是制备降血脂药贝利贝特的中间体,制备J的一种合成路线设计如下:
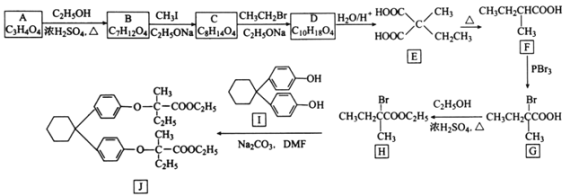
回答下列问题:
(1)A的化学名称是________________。
(2)G生成H的反应类型是________________;J的分子式为________________。
(3)C的结构简式为________________________。
(4)化合物I可由芳香化合物C6H6O和环状化合物C6H10O在醋酸和盐酸催化下制备得到,该反应的化学方程式为________________________________________。
(5)R与E互为同分异构体且与E具有相同的官能团种类和数目,则R的结构有________种。其中对应的核磁共振氢谱图中有四组峰,且峰面积比为4:3:2:1的结构简式为________。
(6)苯氧乙酸乙酯(![]() )是一种农药,设计由苯酚和乙醇为起始原料制备苯氧乙酸乙酯的合成路线:________________(无机试剂任选)。
)是一种农药,设计由苯酚和乙醇为起始原料制备苯氧乙酸乙酯的合成路线:________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中,由H2和CO直接制备二甲醚(CH3OCH3),其过程包含以下反应:
i.CO(g)+2H2(g)![]() CH3OH(g) H1=90.1kJ·mol1
CH3OH(g) H1=90.1kJ·mol1
ii.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
CH3OCH3(g)+H2O(g) H2=24.5kJ·mol1
当其他条件相同时,由H2和CO直接制备二甲醚的反应中,CO平衡转化率随条件X 的变化曲线如右图所示。下列说法正确的是
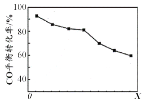
A . 由H2和CO直接制备二甲醚的反应为放热反应
B. 条件X为压强
C. X增大,二甲醚的产率一定增大
D. X增大,该反应的平衡常数一定减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com