
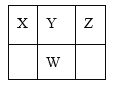
【题目】下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,X和Z两元素的原子序数之和等于W元素的原子序数。下列说法正确的是( )
A.X、W分别与Y都能形成两种或两种以上的化合物,这些化合物都是酸性氧化物
B.X、Y、Z都能形成10电子的氢化物,其中Z的最简单氢化物沸点最高
C.X、Y、W与氢四种元素能组成离子化合物,该化合物一定能发生水解
D.X和W两元素的氧化物对应的水化物的酸性:X>W
【答案】C
【解析】
W、X、Y、Z为短周期主族元素,由位置可知X、Y、Z位于第二周期,W位于第三周期,X和Z两元素的原子序数之和等于W元素的原子序数,设Y的原子序数为n,则n-1+n+1=n+8,解得n=8,可知X为N、Y为O、Z为F、W为S,以此来解答。
由分析知:X为N、Y为O、Z为F、W为S;
A.N的氧化物中N2O3和N2O5是酸性氧化物,而NO、NO2等不是酸性氧化物,S的氧化物SO3和SO2均为酸性氧化物,故A错误;
B.N、O、F形成的10电子氢化物是NH3、H2O和HF,其中H2O沸点最高,故B错误;
C.N、O、S与氢四种元素组成的离子化合物是NH4HSO4、NH4HSO3、(NH4)2SO4和(NH4)2SO3等,其中NH4+和SO32-在水溶液中均发生水解,故C正确;
D.N和S的最高价氧化物的水化物的酸性是H2SO4>HNO3,而H2SO3的酸性小于HNO3,故D错误;
故答案为C。


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】某温度下2L密闭容器中,3种气体起始状态和平衡状态时的物质的量(n)如下表所示.下列说法正确的是( )
X | Y | W | |
n(起始状态)/mol | 2 | 1 | 0 |
n(平衡状态)/mol | 1 | 0.5 | 1.5 |
A.该温度下,此反应的平衡常数K=6.75
B.若升高温度,W的体积分数减小,则此反应△H>0
C.增大压强,正、逆反应速率均增大,平衡向正反应方向移动
D.该温度下,此反应的平衡常数表达式是 K= ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y 能用于高性能光学树脂的合成,可由化合物X与2 甲基丙烯酰氯在一定条件下反应制得:
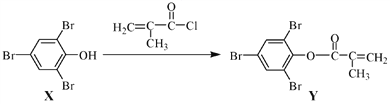
下列有关化合物X、Y 的说法正确的是
A. X 分子中所有原子一定在同一平面上 B. Y与Br2的加成产物分子中含有手性碳原子
C. X、Y均不能使酸性KMnO4溶液褪色 D. X→Y的反应为加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20mL0.1mol·L-1一元弱酸HA溶液中滴加0.1mol·L-1NaOH溶液,溶液中1g![]() 与pH关系如图所示。下列说法不正确的是
与pH关系如图所示。下列说法不正确的是
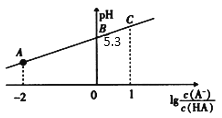
A.A点对应溶液中:c(A-)>c(Na+)>c(H+)>c(OH-)
B.25℃时,HA酸的电离常数的数量级为 10-6
C.对C点溶液加水稀释,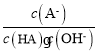 一定减小
一定减小
D.当加入NaOH溶液体积为10 mL时,水的电离受到了抑制
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水约占地球总储水量的97%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量氯化钠,氯化钠的电子式为________________,氯化钠中的非金属元素在元素周期表中的位置为第________周期第________族。
(2)目前,国际上广泛应用的海水淡化的主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得到高纯度淡水,由此可判断蒸馏的过程中发生的是________(填“物理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应方程式为________________________,检验阳极产物的方法是________________________。
(4)工业上从海水中提取溴,第一步是将氯气通入富含溴离子的海水中,将溴置换出来;第二步用空气把溴吹出,用SO2的水溶液吸收,使溴转化为氢溴酸;第三步用氯气氧化氢溴酸即得单质溴。写出上述过程中第一、二步发生反应的离子方程式:①______________________;②____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn、Fe及其化合物在生产生活中应用比较广泛。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量FeO和CuO等杂质)制取金属锌的工艺流程如下:

(1)为了提高酸浸效率,可采用的措施有___________________________________(任答两条);
写出ZnFe2O4溶于酸的离子方程式____________________________________
(2)向净化Ⅰ操作中加入ZnO的目的___________________________________
(3)若净化后的溶液中Cu2+浓度为1×10-12mol/L,则净化后溶液中Zn2+浓度为__________(已知:室温下Ksp(ZnS)=1.6×10-24, Ksp(CuS)=6.4×10-36)
(4)“电解”工艺制锌时Zn2+利用率较低,废液中有大 量的Zn2+ 残留。某化工厂拟采用改变酸锌比净化废液的方式来提高原料的利用率,降低成本。如图是工业生产中不同酸锌比时净化液利用率对电解时直流电耗能影响关系图。根据图分析,该工厂净化废液时的最佳酸锌比为______。

A. 5:1 B.6:1 C.7:1 D.10:1
(5)ZnFe2O4是一种性能优良的软磁材料,工业上常利用ZnFe2(C2O4)3·6H2O隔绝空气加热分解制备,该晶体的热分解化学方程式为_______________________________________。测热分解后产品中ZnFe2O4的质量分数方法如下:取a克产品用H2SO4溶解后加入足量KI溶液充分反应,调溶液至弱酸性,再加入淀粉指示剂,用c mol/L Na2S2O3标准溶液滴定,用去此标准溶液v mL时,刚好到达滴定终点,则此产品中ZnFe2O4的质量分数为____________(用a、c、v表示)。(已知:I2+2S2O32-=2I-+S4O62-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组为探究![]() 和
和![]() 的性质,将两种气体同时通入水中,实验装置如图:
的性质,将两种气体同时通入水中,实验装置如图:
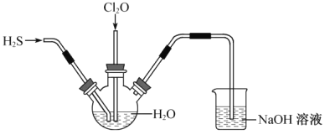
请回答:(1)三颈瓶中出现淡黄色沉淀,溶液呈强酸性,用一个化学方程式表示________。
(2)若通入水中的![]() 已过量,设计实验方案检验________。
已过量,设计实验方案检验________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量是衡量一个国家石油化工发展水平的重要标志之一,以乙烯为原料合成的部分产品如图所示。下列有关说法正确的是
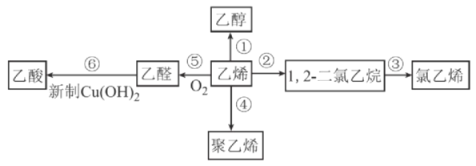
A.氧化反应有①⑤⑥,加成反应有②③
B.氯乙烯、聚乙烯都能使酸性KMnO4溶液褪色
C.反应⑥的现象为产生砖红色沉淀
D.可用乙醇萃取Br2的CCl4溶液中的Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com