
【题目】25℃时,在20mL0.1mol·L-1一元弱酸HA溶液中滴加0.1mol·L-1NaOH溶液,溶液中1g![]() 与pH关系如图所示。下列说法不正确的是
与pH关系如图所示。下列说法不正确的是
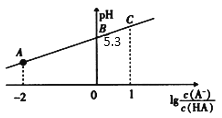
A.A点对应溶液中:c(A-)>c(Na+)>c(H+)>c(OH-)
B.25℃时,HA酸的电离常数的数量级为 10-6
C.对C点溶液加水稀释,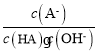 一定减小
一定减小
D.当加入NaOH溶液体积为10 mL时,水的电离受到了抑制
【答案】C
【解析】
A.据图可知A点对应溶液的pH<7,显酸性,则c(H+)>c(OH-),结合电荷守恒c(Na+)+c(H+)=c(A-)+c(OH-)可知:c(A-)>c(Na+)>c(H+)>c(OH-),故A正确;
B.据图可知B点1g![]() =0,即
=0,即![]() =1,pH=5.3,即c(H+)=10-5.3mol/L,所以HA的电离平衡常数Ka=
=1,pH=5.3,即c(H+)=10-5.3mol/L,所以HA的电离平衡常数Ka=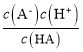 =10-5.3,数量级为 10-6,故B正确;
=10-5.3,数量级为 10-6,故B正确;
C.A-的水解平衡常数表达式为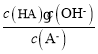 ,加水稀释水解平衡常数不变,则
,加水稀释水解平衡常数不变,则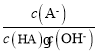 不变,故C错误;
不变,故C错误;
D.加入NaOH溶液体积为10mL时,溶液中的溶质为等物质的量浓度的NaA和HA,HA的电离平衡常数为Ka=10-5.3,则其水解平衡常数Kh=![]() =10-8.7< Ka,所以此时溶液中的HA的电离程度大于A-的水解程度,酸的电离抑制水的电离,则此时水的电离受到抑制,故D正确;
=10-8.7< Ka,所以此时溶液中的HA的电离程度大于A-的水解程度,酸的电离抑制水的电离,则此时水的电离受到抑制,故D正确;
故答案为C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常温时,在H2CO3溶液中逐滴加入NaOH溶液,溶液中H2CO3、![]() 和
和![]() 的物种分布分数α(X)=
的物种分布分数α(X)=![]() 与pH的关系如图所示:
与pH的关系如图所示:
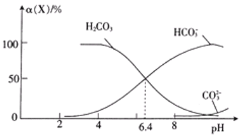
下列说法正确的是
A.![]() H++
H++![]() 的lgK=-6.4
的lgK=-6.4
B.pH=8的溶液中:c(Na+)>c(![]() )
)
C.NaHCO3溶液中滴入少量盐酸至溶液显中性:c(Na+)=c(Cl-)
D.向pH=6.4的溶液中滴加NaOH溶液至pH=8,主要发生的离子反应:![]() +OH-=
+OH-=![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国卫生部门制定的《关于宣传吸烟有毒与控制吸烟》的通知中规定:“中学生不准吸烟”。香烟燃烧产生的烟气中,有多种有害物质,其中尼古丁(C10H14N2)对人体危害最大,下列说法正确的是( )
A.尼古丁的摩尔质量是162g
B.尼古丁中C、H、O三种元素的质量比为10:14:2
C.尼古丁中氮元素的质量分数为17.3%
D.尼古丁是由26个原子构成的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A经李比希法和质谱法分析得知其分子式为C8H8O2,相对分子质量为136,A的核磁共振氢谱有4个峰且面积之比为1:2:2:3,A分子中只含一个苯环,且苯环上只有一个取代基,其核磁共振氢谱与红外光谱如图。关于A的下列说法中不正确的是( )
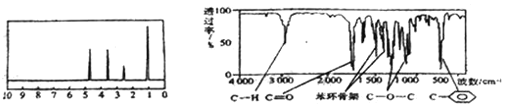
A.A分子属于酯类化合物,在一定条件下能发生水解反应
B.A在一定条件下可与3molH2发生加成反应
C.符合题中A分子结构特征的有机物只有一种
D.与A属于同类化合物的同分异构体只有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。可以用NH3和SiH4(硅烷)在一定条件下反应制得3SiH4+4NH3![]() Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
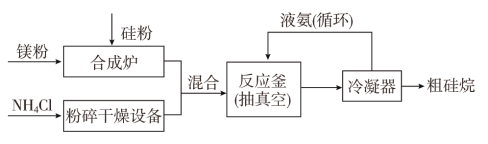
反应原理:4NH4Cl+Mg2Si![]() 4NH3↑+SiH4↑+2MgCl2(ΔH<0)
4NH3↑+SiH4↑+2MgCl2(ΔH<0)
①NH4Cl中的化学键类型有________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是____________________________。
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式:___________________________________________________,实验室可利用如图所示装置完成该反应。
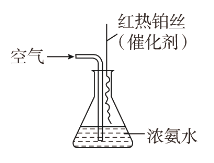
在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是________。
(2)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可作抗酸剂。它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为________________________________。将0.184 g三硅酸镁加入到50 mL 0.1 mol/L盐酸中,充分反应后,滤去沉淀,用0.1 mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O中的n值为________。(注:Mg2Si3O8的摩尔质量为260 g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易反应,生成一种氯化物和两种常见的氮氧化物,其中一种呈红棕色。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如图所示:
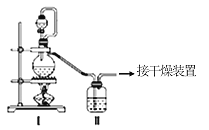
为制备纯净干燥的气体,下表中缺少的药品是:
制备原料 | 装置Ⅰ | 装置Ⅱ | |
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①________ | 饱和食盐水 |
制备纯净NO | Cu | 稀硝酸 | ②________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
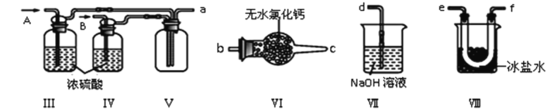
①装置连接顺序为a→_______(按气流自左向右方向,用小写字母表示)。
②为了使实验顺利进行,实验中先通入的气体是_____(填Cl2或NO),待装置Ⅴ中充满气体时,再将另一气体缓缓通入,此操作的目的是_____。
③装置Ⅴ生成NOCl的化学方程式是_____。
④装置Ⅵ的作用为_____,若无该装置,Ⅷ中NOCl可能发生反应的化学方程式为_______。
(3)丁组同学用以下方法测定亚硝酰氯(NOCl)纯度:取Ⅷ中所得液体m克溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol/LAgNO3 标准溶液滴定至终点,消耗标准溶液的体积为b mL。亚硝酰氯(NOCl)的质量分数为_________(用代数式表示即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,X和Z两元素的原子序数之和等于W元素的原子序数。下列说法正确的是( )
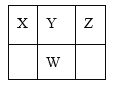
A.X、W分别与Y都能形成两种或两种以上的化合物,这些化合物都是酸性氧化物
B.X、Y、Z都能形成10电子的氢化物,其中Z的最简单氢化物沸点最高
C.X、Y、W与氢四种元素能组成离子化合物,该化合物一定能发生水解
D.X和W两元素的氧化物对应的水化物的酸性:X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.将Fe2O3加入到HI溶液中:Fe2O3+6H+=2Fe3++3H2O
B.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++H2O=4Na++2Cu(OH)2↓+O2↑
C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S+2Cl-
D.已知电离平衡常数:H2CO3>HClO>HCO![]() ,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO
,向NaClO溶液中通入少量CO2:2ClO-+CO2+H2O=2HClO+CO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]化合物J是制备降血脂药贝利贝特的中间体,制备J的一种合成路线设计如下:
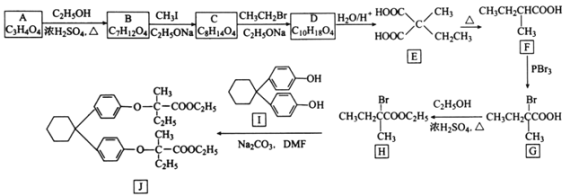
回答下列问题:
(1)A的化学名称是________________。
(2)G生成H的反应类型是________________;J的分子式为________________。
(3)C的结构简式为________________________。
(4)化合物I可由芳香化合物C6H6O和环状化合物C6H10O在醋酸和盐酸催化下制备得到,该反应的化学方程式为________________________________________。
(5)R与E互为同分异构体且与E具有相同的官能团种类和数目,则R的结构有________种。其中对应的核磁共振氢谱图中有四组峰,且峰面积比为4:3:2:1的结构简式为________。
(6)苯氧乙酸乙酯(![]() )是一种农药,设计由苯酚和乙醇为起始原料制备苯氧乙酸乙酯的合成路线:________________(无机试剂任选)。
)是一种农药,设计由苯酚和乙醇为起始原料制备苯氧乙酸乙酯的合成路线:________________(无机试剂任选)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com