
����Ŀ���輰�仯��������Ȼ��㷺���ڲ�������Ӧ�á�
(1)������Ĥ���������Ĥ��ȽϾ��б��滯ѧ�����ȶ����ŵ㣬�ʵ�����Ĥ�����ڰ뵼�幤ҵ��������NH3��SiH4(����)��һ�������·�Ӧ�Ƶ�3SiH4��4NH3![]() Si3N4��12H2
Si3N4��12H2
�Թ軯þΪԭ���Ʊ�����ķ�Ӧ��ҵ�������£�
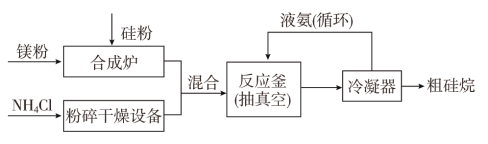
��Ӧԭ����4NH4Cl��Mg2Si![]() 4NH3����SiH4����2MgCl2(��H<0)
4NH3����SiH4����2MgCl2(��H<0)
��NH4Cl�еĻ�ѧ��������________��SiH4�ĵ���ʽΪ______________��
��������������Ĺ�����Һ����������____________________________��
�۰�������Ҫ�Ĺ�ҵԭ�ϣ�д������������������Ӧ����NO�Ļ�ѧ����ʽ��___________________________________________________��ʵ���ҿ�������ͼ��ʾװ����ɸ÷�Ӧ��
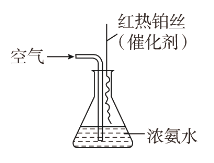
��ʵ������У����۲쵽��ƿ�в�������ɫ�����⣬���ɹ۲쵽�а������ɣ����̵���Ҫ�ɷ���________��
(2)������þ(Mg2Si3O8��nH2O)������ˮ����ҽҩ�Ͽ���������������˿����к�θҺ�ж�����֮�⣬���ɵ�H2SiO3���ɸ������������θ���棬�����䲻���ܴ̼���������þ�����ᷴӦ�Ļ�ѧ����ʽΪ________________________________����0.184 g������þ���뵽50 mL 0.1 mol/L�����У���ַ�Ӧ����ȥ��������0.1 mol/L NaOH��Һ�ζ�ʣ������ᣬ����NaOH��Һ30 mL����Mg2Si3O8��nH2O�е�nֵΪ________��(ע��Mg2Si3O8��Ħ������Ϊ260 g/mol)
���𰸡����Լ�(�ۼ�)�����Ӽ� 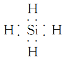 ������������֤��Ӧ�ڳ����½���(�����䡱���¡�����) 4NH3��5O2
������������֤��Ӧ�ڳ����½���(�����䡱���¡�����) 4NH3��5O2![]() 4NO��6H2O NH4NO3(�������) Mg2Si3O8��nH2O��4HCl=3H2SiO3��2MgCl2��(n��1)H2O 6
4NO��6H2O NH4NO3(�������) Mg2Si3O8��nH2O��4HCl=3H2SiO3��2MgCl2��(n��1)H2O 6
��������
��1�����Ȼ����笠����Ӻ�������֮�������Ӽ���笠������ڲ����ڹ��ۼ������ݵ���ʽ����д�������ش�
�ڸ���Һ�������ʣ���Һ�����ش�
�۰����Ĵ�����������һ��������ˮ��һ��������������Ѹ�ٱ�Ϊ���������������������Ժ�ˮ��Ӧ�õ����ᣬ������ԺͰ�����Ӧ��������泥�
��2��������д��ѧ����ʽ�IJ��裺д��ע�ȣ���ȷ��д����ʽ���ɣ����ݻ�ѧ����ʽ���м��㡣
��1�����Ȼ����笠����Ӻ�������֮�������Ӽ���笠������ڲ����ڹ��ۼ������Լ����ۼ��������Ӽ���������й�ԭ�Ӻ���ԭ��֮���Թ��ۼ���ϣ�����ʽΪ��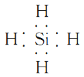 ��
��
��Һ�������ʣ���Һ����������������Ĺ�����Һ���������ǣ�������������֤��Ӧ�ڳ����½��У��ʴ�Ϊ��������������֤��Ӧ�ڳ����½��У������䡱���¡����ɣ���
�۰����Ĵ�����������һ��������ˮ����4NH3��5O2![]() 4NO��6H2O����ʵ������У����۲쵽��ƿ�в�������ɫ�����⣬���ɹ۲쵽�а������ɣ���Ϊһ��������������Ѹ�ٱ�Ϊ���������������������Ժ�ˮ��Ӧ�õ����ᣬ������ԺͰ�����Ӧ����NH4NO3(�������)��
4NO��6H2O����ʵ������У����۲쵽��ƿ�в�������ɫ�����⣬���ɹ۲쵽�а������ɣ���Ϊһ��������������Ѹ�ٱ�Ϊ���������������������Ժ�ˮ��Ӧ�õ����ᣬ������ԺͰ�����Ӧ����NH4NO3(�������)��
��2��������þ�к�θ�ᣨHCl���Ļ�ѧ����ʽΪ��Mg2Si3O8��nH2O��4HCl=3H2SiO3��2MgCl2��(n��1)H2O�����ݻ�ѧ����ʽ����0.184g Mg2Si3O8��nH2O�����ʵ�����x���ã�

![]() =
=![]() �����x=0.0005mol������MgSi3O8nH2O��Ħ��������(260+18n) g/mol =368g/mol��Mg2Si3O8��Ħ������Ϊ260g/mol������18n=108����n=6��
�����x=0.0005mol������MgSi3O8nH2O��Ħ��������(260+18n) g/mol =368g/mol��Mg2Si3O8��Ħ������Ϊ260g/mol������18n=108����n=6��


 ��ѧ��������������Ͼ���ѧ������ϵ�д�
��ѧ��������������Ͼ���ѧ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ȫ���¹ڲ����Ĺؼ�ʱ�ڣ�ר��ָ��������୶������¹ڲ�����Ⱦ������Ч����������୵ķ��ӽṹ��ͼ��ʾ�����й��ڸ��л����˵����ȷ���ǣ� ��
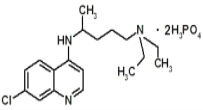
A.���л���ķ���ʽΪ��C18H30N3O8P2Cl
B.���л����ܹ������ӳɷ�Ӧ��ȡ����Ӧ�����ܷ���������Ӧ
C.���л��ﱽ���ϵ�1-�����ֻ��2��
D.1mol���л�������ܺ�8molNaOH������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽�����������ķ�Ӧ��ijͬѧ����������µ�ʵ�鷽��(��֪FeCl3����ʱ������)����ʵ��װ��ͼΪ(�����õľƾ�������ȥ)��
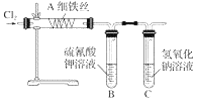
(1)�Թ�B�е�������___________����Ӧ�����ӷ���ʽΪ____________��
(2)�Թ�C������������Һ��������____________����Ӧ�����ӷ���ʽΪ_________��
(3)ijͬѧ�Ҳ²�����������Ӧ���ܻ��������Ȼ�������Ϊ��̽�����������Ƿ����Ȼ�����(����������ȫ��Ӧ)���������ʵ�鷽����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Y �����ڸ����ܹ�ѧ��֬�ĺϳɣ����ɻ�����X��2 ����ϩ������һ�������·�Ӧ�Ƶã�
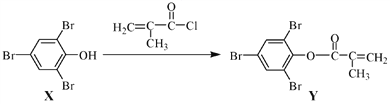
�����йػ�����X��Y ��˵����ȷ����
A. X ����������ԭ��һ����ͬһƽ���� B. Y��Br2�ļӳɲ�������к�������̼ԭ��
C. X��Y������ʹ����KMnO4��Һ��ɫ D. X��Y�ķ�ӦΪ�ӳɷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���Է��Ѵ�����Ϊԭ�ϣ���������ͬʱ�������Ʊ��������������V2O5������Ҫ������ͼ��

��֪����![]() +2H+
+2H+![]()
![]() +H2O ��NH4VO3������ˮ����������ˮ���������Ҵ�
+H2O ��NH4VO3������ˮ����������ˮ���������Ҵ�
(l)��ȡ��������߽�ȡ�ʵķ���______(��дһ��)
(2)�����е�V2O3��CaCO3��Ϻ��ڿ����б���ʱת��ΪCa(VO3)2ͬʱ�ͷų�һ���������壬д���÷�Ӧ�Ļ�ѧ����ʽ_____��
(3)Ca(VO3)2������ˮ��������ϡ���ᣬ����ƽ���ƶ�ԭ��������ԭ��_____������Һ�к������ʵĻ�ѧʽΪ_________��
(4)���˺����Ҵ�����ˮ��ϴ�ӳ�����ԭ����______��
(5)���������õ�ƫ�����(NH4VO3)��������Һ��c(![]() )=0.1molL-1��Ϊʹ��Ԫ�صij����ʴﵽ98%������Ӧ����c(
)=0.1molL-1��Ϊʹ��Ԫ�صij����ʴﵽ98%������Ӧ����c(![]() )Ϊ_____molL-1[��֪Ksp(NH4VO3)=1.6��10-3]
)Ϊ_____molL-1[��֪Ksp(NH4VO3)=1.6��10-3]
(6)����NH4VO3ʱ�������������¶ȱ仯��������ͼ��ʾ�����ȵ�200��ʱ���õ��Ĺ������ʻ�ѧʽΪ_____��
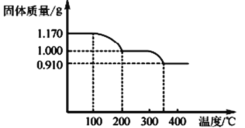
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����20mL0.1mol��L��1һԪ����HA��Һ�еμ�0.1mol��L��1NaOH��Һ����Һ��1g![]() ��pH��ϵ��ͼ��ʾ������˵������ȷ����
��pH��ϵ��ͼ��ʾ������˵������ȷ����
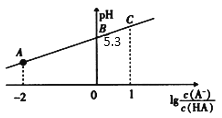
A.A���Ӧ��Һ�У�c(A��)>c(Na+)>c(H+)>c(OH��)
B.25��ʱ��HA��ĵ��볣����������Ϊ 10��6
C.��C����Һ��ˮϡ�ͣ�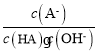 һ����С
һ����С
D.������NaOH��Һ���Ϊ10 mLʱ��ˮ�ĵ����ܵ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ұ���в����漰�ķ�Ӧ������(����)
A.������ԭ��ӦB.�û���Ӧ
C.�ȷֽⷴӦD.���ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Zn��Fe���仯����������������Ӧ�ñȽϹ㷺����ҵ������п��ɰ(��Ҫ��ZnO��ZnFe2O4,����������FeO��CuO������)��ȡ����п�Ĺ����������£�

(1)Ϊ��������Ч�ʣ��ɲ��õĴ�ʩ��___________________________________(�δ�����)��
д��ZnFe2O4����������ӷ���ʽ____________________________________
(2)��������м���ZnO��Ŀ��___________________________________
(3)�����������Һ��Cu2+Ũ��Ϊ1��10-12mol/L,������Һ��Zn2+Ũ��Ϊ__________(��֪��������Ksp(ZnS)=1.6��10-24, Ksp(CuS)=6.4��10-36)
(4)�������������пʱZn2+�����ʽϵͣ���Һ���д� ����Zn2+ ������ij����������øı���п�Ⱦ�����Һ�ķ�ʽ�����ԭ�ϵ�������,���ͳɱ�����ͼ�ǹ�ҵ�����в�ͬ��п��ʱ����Һ�����ʶԵ��ʱֱ�������Ӱ���ϵͼ������ͼ�������ù���������Һʱ�������п��Ϊ______��

A. 5:1 B.6:1 C.7:1 D.10:1
(5)ZnFe2O4��һ���������������Ų��ϣ���ҵ�ϳ�����ZnFe2(C2O4)3��6H2O�����������ȷֽ��Ʊ����þ�����ȷֽ⻯ѧ����ʽΪ_______________________________________�����ȷֽ���Ʒ��ZnFe2O4�����������������£�ȡa�˲�Ʒ��H2SO4�ܽ���������KI��Һ��ַ�Ӧ������Һ�������ԣ��ټ������ָʾ������c mol/L Na2S2O3����Һ�ζ�����ȥ�˱���Һv mLʱ���պõ���ζ��յ㣬��˲�Ʒ��ZnFe2O4����������Ϊ____________(��a��c��v��ʾ)��(��֪��I2+2S2O32��=2I��+S4O62��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к����������ϩ�OCH2CH2O���ظ���Ԫ���л���й��ѣ�18���ک�6�Ľṹ��ʽ��ͼ��ʾ������˵����ȷ���ǣ�������
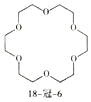
A.�÷���������ԭ�ӿ��ܹ�ƽ��
B.�÷��ӵ�һ�ȴ���ֻ��1��
C.���л�������ʽ�������ǵ���ͬ
D.18���ک�6�е���18��ָ���Ӻ���18��̼ԭ�ӣ���6��ָ���Ӻ���6����ԭ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com