
【题目】工业上以钒钛磁铁矿为原料,在炼铁的同时还可以制备钒的最高价氧化物V2O5,其主要流程如图:

已知:①![]() +2H+
+2H+![]()
![]() +H2O ②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
+H2O ②NH4VO3微溶于冷水,易溶于热水,不溶于乙醇
(l)浸取过程中提高浸取率的方法______(任写一种)
(2)钒渣中的V2O3与CaCO3混合后在空气中焙烧时转化为Ca(VO3)2同时释放出一种温室气体,写出该反应的化学方程式_____。
(3)Ca(VO3)2难溶于水但能溶于稀硫酸,试用平衡移动原理分析其原因_____,浸出液中含钒物质的化学式为_________。
(4)过滤后用乙醇代替水来洗涤沉淀的原因是______。
(5)“沉钒”得到偏钒酸铵(NH4VO3),若浸出液中c(![]() )=0.1molL-1,为使钒元素的沉降率达到98%,至少应调节c(
)=0.1molL-1,为使钒元素的沉降率达到98%,至少应调节c(![]() )为_____molL-1[已知Ksp(NH4VO3)=1.6×10-3]
)为_____molL-1[已知Ksp(NH4VO3)=1.6×10-3]
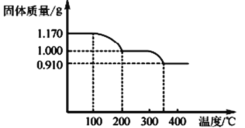
(6)煅烧NH4VO3时,固体质量随温度变化的曲线如图所示。加热到200℃时,得到的固体物质化学式为_____。
【答案】粉碎/加热/搅拌/适当提高硫酸浓度 V2O3+O2+CaCO3![]() Ca(VO3)2+CO2 加入硫酸使
Ca(VO3)2+CO2 加入硫酸使![]() +2H+
+2H+![]() +H2O中c(
+H2O中c(![]() )降低,Ca(VO3)2溶解平衡Ca(VO3)2(s) Ca2+(aq)+
)降低,Ca(VO3)2溶解平衡Ca(VO3)2(s) Ca2+(aq)+![]() (aq)正向移动,Ca(VO3)2溶解 (VO2)2SO4 NH4VO3不溶于乙醇,减少损失 0.8 HVO3
(aq)正向移动,Ca(VO3)2溶解 (VO2)2SO4 NH4VO3不溶于乙醇,减少损失 0.8 HVO3
【解析】
钒钛磁铁矿高温煅烧得到铁水和钒渣,钒渣中的V2O3与CaCO3混合后在空气中焙烧时转化为Ca(VO3)2,根据元素守恒可知同时得到CO2;Ca(VO3)2悬浊液中存在沉淀溶解平衡Ca(VO3)2(s)Ca2+(aq)+![]() (aq)正向移动,加入硫酸使
(aq)正向移动,加入硫酸使![]() +2H+
+2H+![]() +H2O平衡正向移动,得到含
+H2O平衡正向移动,得到含![]() 的溶液,溶液中加入碳酸氢铵溶液得到NH4VO3沉淀,过滤洗涤干燥后高温煅烧得到V2O5。
的溶液,溶液中加入碳酸氢铵溶液得到NH4VO3沉淀,过滤洗涤干燥后高温煅烧得到V2O5。
(1)粉碎、加热、搅拌、适当提高硫酸浓度都可以提高浸取率;
(2)根据元素守恒可知该温室气体应为CO2,化学方程式为V2O3+O2+CaCO3![]() Ca(VO3)2+CO2;
Ca(VO3)2+CO2;
(3)根据题目信息可知,加入硫酸可使![]() +2H+
+2H+![]() +H2O平衡正向移动,c(
+H2O平衡正向移动,c(![]() )降低,Ca(VO3)2溶解平衡Ca(VO3)2(s)Ca2+(aq)+
)降低,Ca(VO3)2溶解平衡Ca(VO3)2(s)Ca2+(aq)+![]() (aq)正向移动,Ca(VO3)2溶解;浸出液中V元素存在形式为
(aq)正向移动,Ca(VO3)2溶解;浸出液中V元素存在形式为![]() ,溶液中的阴离子为硫酸根,所以含钒物质的化学式为(VO2)2SO4;
,溶液中的阴离子为硫酸根,所以含钒物质的化学式为(VO2)2SO4;
(4)根据题目信息可知NH4VO3不溶于乙醇,所以用乙醇洗涤可以减少溶解损耗;
(5)浸出液中c(![]() )=0.1molL-1,沉淀率达到98%时,溶液中c(
)=0.1molL-1,沉淀率达到98%时,溶液中c(![]() )=0.1molL-1×(1-98%)=0.002mol/L,则c(
)=0.1molL-1×(1-98%)=0.002mol/L,则c(![]() )=
)= =0.8 molL-1;
=0.8 molL-1;
(6)铵盐不稳定受热易分解,根据最终产物V2O5可知分解过程不是氧化还原过程,所以NH4VO3受热分解过程中会产生NH3,1.17gNH4VO3的物质的量为![]() =0.01mol,根据元素守恒可知加热分解过程可以产生0.01mol氨气,加热到200℃时,固体减少的质量为0.17g,刚好是0.01molNH3,所以该段发生的反应为NH4VO3
=0.01mol,根据元素守恒可知加热分解过程可以产生0.01mol氨气,加热到200℃时,固体减少的质量为0.17g,刚好是0.01molNH3,所以该段发生的反应为NH4VO3![]() NH3↑+HVO3,此时剩余的固体物质为HVO3。
NH3↑+HVO3,此时剩余的固体物质为HVO3。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】实验室用下图所示的装置制取少量溴苯。

请回答下列问题:
(1)在烧瓶a中反应的化学方程式是__________________________________________。
(2)与烧瓶口垂直的一段长导管的作用是______________________________________。
(3)锥形瓶C中盛放四氯化碳的作用是________________________________________。
(4)能证明苯和液溴发生的是取代反应,而不是加成反应,可向锥形瓶C中加入硝酸银溶液,若________,则能证明。另一种验证的方法是向锥形瓶C中加入________________________,现象是________________________________________________________________________。
(5)生成的溴苯因溶有未反应的溴而显褐色,提纯的方法是____________________________。
(6)实验结束时,将氢氧化钠溶液倒入烧瓶中,充分振荡,目的是_________________________,反应的化学方程式是_____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。
(1)汽车内燃机工作时发生反应:N2(g)+O2(g)![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
2NO(g),是导致汽车尾气中含有NO的原因之一。T℃时,向5L密闭容器中充入6.5molN2和7.5molO2,在5min时反应达到平衡状态,此时容器中NO的物质的量是5mol。
①5min内该反应的平均速率υ(NO)=___;在T℃时,该反应的平衡常数K=___。
②反应开始至达到平衡的过程中,容器中下列各项发生变化的是___(填序号)。
a.混合气体的密度
b.混合气体的压强
c.正反应速率
d.单位时间内,N2和NO的消耗量之比
(2)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢化钠(NaH)是一种白色的离子化合物,其中钠元素为+1价,NaH与水反应生成氢气,下列叙述正确的是( )
A.NaH在水中显酸性B.NaH中氢离子电子排布与氦原子相同
C.NaH中氢离子半径比锂离子大D.NaH中氢离子可以被还原成氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.(CH3)2C(Cl)CH2CH3的名称为:2-氯-2-甲基丁烷
B.可用新制氢氧化铜浊液鉴别乙醇、乙酸溶液
C.1mol有机物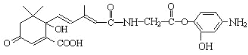 )与NaOH溶液反应,最多消耗5molNaOH
)与NaOH溶液反应,最多消耗5molNaOH
D.1molβ-紫罗兰酮(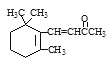 )与1molBr2发生加成反应可得到3种不同产物(不考虑立体异构)
)与1molBr2发生加成反应可得到3种不同产物(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。可以用NH3和SiH4(硅烷)在一定条件下反应制得3SiH4+4NH3![]() Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
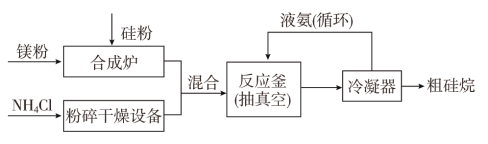
反应原理:4NH4Cl+Mg2Si![]() 4NH3↑+SiH4↑+2MgCl2(ΔH<0)
4NH3↑+SiH4↑+2MgCl2(ΔH<0)
①NH4Cl中的化学键类型有________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是____________________________。
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式:___________________________________________________,实验室可利用如图所示装置完成该反应。
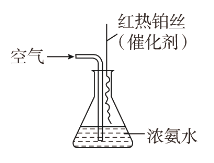
在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是________。
(2)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可作抗酸剂。它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为________________________________。将0.184 g三硅酸镁加入到50 mL 0.1 mol/L盐酸中,充分反应后,滤去沉淀,用0.1 mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O中的n值为________。(注:Mg2Si3O8的摩尔质量为260 g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含碳化合物在生产生活中广泛存在,Andren Dasic等提出在M+的作用下以N2O为氧化剂可以氧化乙烯生成乙醛,催化体系氧化还原循环如图所示,请回答下列问题。
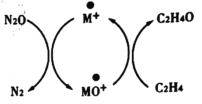
(1)已知N2O(g)+M+(s)=N2(g)+MO+(s) ΔH1=+678kJ·mol-1
MO+(s)+C2H4(g)=C2H4O(g)+M+(s) ΔH2=-283kJ·mol-1
请写出在M+的作用下以N2O为氧化剂氧化乙烯生成乙醛的热化学方程式:_________
(2)已知在含少量的I2溶液中,反应CH3CHO (aq)![]() CH4 (g) +CO (g)分两步进行:第Ⅰ步反应CH3CHO (aq) +I2 (aq) →CH3I (l) +HI (aq) +CO (g) (慢反应),第II步为快反应。
CH4 (g) +CO (g)分两步进行:第Ⅰ步反应CH3CHO (aq) +I2 (aq) →CH3I (l) +HI (aq) +CO (g) (慢反应),第II步为快反应。
①决定此反应快慢的是第______(填“Ⅰ”或“II”)步反应
②请写出第II步反应的化学方程式:_________
(3)若物质与氧原子的结合力用OA表示,氧原子与N2生成N2O的结合力OA(N2) =167.4 kJ·mol-1, 氧原子与乙烯生成乙醛的结合力OA (C2H4) = 473 kJ·mol-1,则可做该反应催化剂的M+与氧原子的的结合力OA (M+)的值应满足________,使用催化剂会使该反应的活化能________ (填“增大”、 “减小”、“不变”)。
(4)某2L容器中发生: 2CO2(g)![]() 2CO (g)+O2 (g),2molCO2在不同温度下平衡分解的情况如图所示。
2CO (g)+O2 (g),2molCO2在不同温度下平衡分解的情况如图所示。
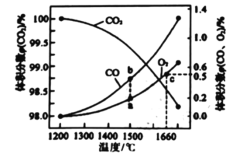
①恒温恒容条件下,能表示该可逆反应达到平衡状态的是______(填标号)
A.CO体积分数与O2体积分数的比值保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.容器内碳元素的质量分数保持不变
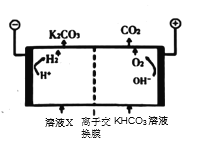
②图中a、b、c三点的平衡常数K(a)、K(b)、K(c)的大小关系为_______
③为实现CO2减排,目前较成熟的方法是用高浓度的K2CO3溶液吸收工业烟气中的CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如图,用必要的文字和化学用语简述![]() 在阴极区再生的原理____________。
在阴极区再生的原理____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 ;
(2)E2+离子的价层电子轨道表示式是 ,F原子的电子排布式是 ;
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为 ,B元素的气态氢化物的分子模型为 ;
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为 ;
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为 ;
(6)某种化合物由D,E,F三种元素组成,其晶胞 如图所示,则其化学式为 ,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:d= g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气(NH3)是一种重要的化工原料,广泛应用于制氮肥、制药、合成纤维等。请回答下列问题:
(1)2molNH3在标准状况下的体积是___。
(2)2molNH3的质量是___,其中所含氢元素的质量是___。
(3)2molNH3所含的氨分子数为___,电子数为___。
(4)工业上用反应N2+3H2 ![]() 2NH3来合成氨气,则若制得2molNH3,标准状况下参与反应的H2的体积为___;14克N2参与反应可得NH3物质的量为___。
2NH3来合成氨气,则若制得2molNH3,标准状况下参与反应的H2的体积为___;14克N2参与反应可得NH3物质的量为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com