
【题目】分子中含有三个以上﹣OCH2CH2O﹣重复单元的有机物叫冠醚,18﹣冠﹣6的结构简式如图所示。下列说法正确的是( )
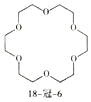
A.该分子中所有原子可能共平面
B.该分子的一氯代物只有1种
C.该有机物的最简式和葡萄糖的相同
D.18﹣冠﹣6中的“18”指分子含有18个碳原子,“6”指分子含有6个氧原子
科目:高中化学 来源: 题型:
【题目】硅及其化合物在自然界广泛存在并被人类应用。
(1)氮化硅膜与二氧化硅膜相比较具有表面化学性能稳定等优点,故氮化硅膜可用于半导体工业。可以用NH3和SiH4(硅烷)在一定条件下反应制得3SiH4+4NH3![]() Si3N4+12H2
Si3N4+12H2
以硅化镁为原料制备硅烷的反应和工业流程如下:
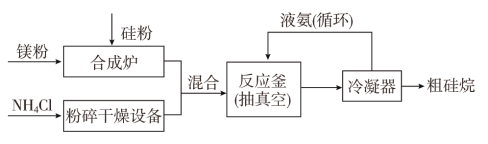
反应原理:4NH4Cl+Mg2Si![]() 4NH3↑+SiH4↑+2MgCl2(ΔH<0)
4NH3↑+SiH4↑+2MgCl2(ΔH<0)
①NH4Cl中的化学键类型有________,SiH4的电子式为______________。
②上述生产硅烷的过程中液氨的作用是____________________________。
③氨气是重要的工业原料,写出氨气发生催化氧化反应生成NO的化学方程式:___________________________________________________,实验室可利用如图所示装置完成该反应。
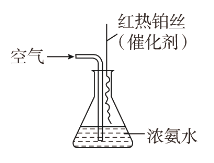
在实验过程中,除观察到锥形瓶中产生红棕色气体外,还可观察到有白烟生成,白烟的主要成分是________。
(2)三硅酸镁(Mg2Si3O8·nH2O)难溶于水,在医药上可作抗酸剂。它除了可以中和胃液中多余酸之外,生成的H2SiO3还可覆盖在有溃疡的胃表面,保护其不再受刺激。三硅酸镁与盐酸反应的化学方程式为________________________________。将0.184 g三硅酸镁加入到50 mL 0.1 mol/L盐酸中,充分反应后,滤去沉淀,用0.1 mol/L NaOH溶液滴定剩余的盐酸,消耗NaOH溶液30 mL,则Mg2Si3O8·nH2O中的n值为________。(注:Mg2Si3O8的摩尔质量为260 g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有Cl2的三个集气瓶甲、乙、丙中各注入下列液体中的一种,经过振荡,现象如下图所示,则甲、乙、丙中注入的液体分别是( )

A. ①②③ B. ③②① C. ②①③ D. ①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】妈妈教小鲁蒸馒头:先用酵头发面,面团发酵至两倍大后,再加纯碱调节酸性,然后将面团揉切后上锅蒸即可。小鲁查阅资料得知,酵头可使面团在微生物作用下产生CO2气体,从而使面团疏松,但同时也会产生乳酸、醋酸等有机酸。
(1)下列关于纯碱的认识正确的是___。
A.受热易分解 B.水溶液显碱性 C.属于碱 D.可与酸反应
(2)小鲁探究用Na2CO3调节面团酸度,而不用NaHCO3的原因。
①Na2CO3与NaHCO3质量均为1g时,消耗H+的物质的量更多的是___。
②以Na2CO3或NaHCO3为例,计算消耗H+的物质的量,写出计算过程。___
(3)小鲁实际操作时,发现面团发得不好,面团内的气孔少,略有酸味。妈妈指导小鲁将Na2CO3改用NaHCO3,继续揉面,上锅蒸后果然蒸出了松软的馒头。解释NaHCO3的作用___。
(4)某品牌复合膨松剂的说明书如图所示。

其中葡萄糖酸-δ-内酯和淀粉是助剂,其作用是防止膨松剂吸潮结块而失效。焦磷酸二氢二钠的作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气(NH3)是一种重要的化工原料,广泛应用于制氮肥、制药、合成纤维等。请回答下列问题:
(1)2molNH3在标准状况下的体积是___。
(2)2molNH3的质量是___,其中所含氢元素的质量是___。
(3)2molNH3所含的氨分子数为___,电子数为___。
(4)工业上用反应N2+3H2 ![]() 2NH3来合成氨气,则若制得2molNH3,标准状况下参与反应的H2的体积为___;14克N2参与反应可得NH3物质的量为___。
2NH3来合成氨气,则若制得2molNH3,标准状况下参与反应的H2的体积为___;14克N2参与反应可得NH3物质的量为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]化合物J是制备降血脂药贝利贝特的中间体,制备J的一种合成路线设计如下:
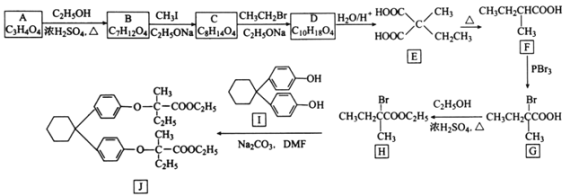
回答下列问题:
(1)A的化学名称是________________。
(2)G生成H的反应类型是________________;J的分子式为________________。
(3)C的结构简式为________________________。
(4)化合物I可由芳香化合物C6H6O和环状化合物C6H10O在醋酸和盐酸催化下制备得到,该反应的化学方程式为________________________________________。
(5)R与E互为同分异构体且与E具有相同的官能团种类和数目,则R的结构有________种。其中对应的核磁共振氢谱图中有四组峰,且峰面积比为4:3:2:1的结构简式为________。
(6)苯氧乙酸乙酯(![]() )是一种农药,设计由苯酚和乙醇为起始原料制备苯氧乙酸乙酯的合成路线:________________(无机试剂任选)。
)是一种农药,设计由苯酚和乙醇为起始原料制备苯氧乙酸乙酯的合成路线:________________(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某恒容密闭容器中加入1.6 mol L-1的NO2后,会发生如下反应:2NO2(g)N2O4(g) △H =-56.9kJmol-1。其中N2O4的物质的量浓度随时间的变化如图所示,下列说法不正确的是

A.升高温度,60s后容器中混合气体颜色加深
B.0-60s内,NO2的转化率为75%
C.0-60s内,v(NO2)=0.02mol L-1 s-1
D.a、b两时刻生成NO2的速率v(a)>v(b)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气作为清洁能源有着广泛的应用前景,采用天然气制备氢气的流程如下。
![]()
请回答下列问题:
Ⅰ.蒸汽转化:在催化剂的作用下,水蒸气将CH4氧化,结合图表信息回答问题。
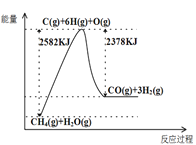
(1)该过程的热化学方程式是__________。
(2)平衡混合物中CO的体积分数与压强的关系如图所示,判断T1和T2的大小关系:T1_______T2(填“>”“<”或“=”),并说明理由__________。

(3)一定温度下,在1L恒容的密闭容器中充入1mol CH4和1mol水蒸气充分反应达平衡后,测得反应前后容器中气体的物质的量之比是3:4,计算该条件下反应的平衡常数为______________。
Ⅱ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅲ.模拟H2提纯工艺:将CO2和H2分离得到H2的过程如下:
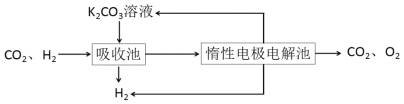
依据图示信息回答:
(4)吸收池中发生反应的离子方程式是_________。
(5)写出电解池中阳极发生的电极反应式________;结合化学用语说明K2CO3溶液再生的原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电致变色器件可智能调控太阳光透过率,从而实现节能。下图是某电致变色器件的示意图。当通电时,Ag+注入到无色WO3薄膜中,生成AgxWO3,器件呈现蓝色,对于该变化过程,下列叙述错误的是
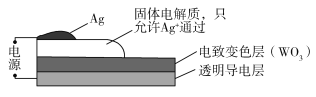
A.Ag为阳极B.Ag+由银电极向变色层迁移
C.W元素的化合价升高D.总反应为:WO3+xAg=AgxWO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com