
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源:物理教研室 题型:022
A. 浮于水面,熔成闪亮的小球,四边游动,逐渐缩小,溶液变红色
B. 产生大量的气体,气体可燃,溶液变浅红色
C. 反应+分剧烈,产生的气体可燃
D. 剧烈反应,产生的气体可燃
E. 生成白色胶状沉淀,继而沉淀消失
F. 生成淡黄色沉淀
(3)实验内容:
实验方案 实验现象 有关化学方程
(4)实验结论:________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
现有下列短周期元素性质的数据:
元素编号
元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径
(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高和最
低化合价 +2 +1 +5 +7 +1 +5 +3
-2 -3 -1 -3
试回答下列问题:
(1)上述元素中处于同一主族的有________,元素②在周期表中的位置为________。
(2)上表中某两种元素,形成的分子中,每个原子都满足最外层为8电子的稳定结构,写出其电子式________。
(3)元素①⑥能形成两种化合物,写出其中较稳定的化,合物与水反应的,离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:022
用砂纸擦后的镁带丐沸水反应,再向反应后溶液中滴加酚酞溶液向新制的H2S饱和溶液中滴加新制的氯水钠与润滴有酚酞的冷水反应镁带与2mol·L-1盐酸反应铝条与2mol·L-1盐酸反应向ALCI3溶液中滴加NaOH溶液至过量
A. 浮于水面,熔成闪亮的小球,四边游动,逐渐缩小,溶液变红色
B. 产生大量的气体,气体可燃,溶液变浅红色
C. 反应+分剧烈,产生的气体可燃
D. 剧烈反应,产生的气体可燃
E. 生成白色胶状沉淀,继而沉淀消失
F. 生成淡黄色沉淀
(3)实验内容:
实验方案 实验现象 有关化学方程
(4)实验结论:________。
(5)问题讨论:①请从结构理论上简单说明上述结论的原因。
②请你补充一组实验方案(简单易行),证明此周期中另两种主族元素的性质递变规律。
现有下列短周期元素性质的数据:
元素编号
元素性质 ① ② ③ ④ ⑤ ⑥ ⑦ ⑧
原子半径
(10-10m) 0.74 1.60 1.52 1.10 0.99 1.86 0.75 0.82
最高和最
低化合价 +2 +1 +5 +7 +1 +5 +3
-2 -3 -1 -3
试回答下列问题:
(1)上述元素中处于同一主族的有________,元素②在周期表中的位置为________。
(2)上表中某两种元素,形成的分子中,每个原子都满足最外层为8电子的稳定结构,写出其电子式________。
(3)元素①⑥能形成两种化合物,写出其中较稳定的化,合物与水反应的,离子方程式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题
(1)常温下,X、Y的水溶液的pH均为5。则两种水溶液中由水电离出的H+浓度之比是 。
(2)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出少量该化合物溶液与足量的Ba(OH)2溶液反应的离子方程式 。
(3)将铝片和镁片用导线相连,插入由A、D、E三种元素组成物质的稀溶液中构成原电池,则负极的电极反应式为 。
(4)化学反应3A2(g)+C2(g) ![]() 2CA3(g)。当反应达到平衡时不断
2CA3(g)。当反应达到平衡时不断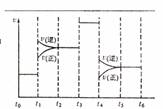
改变条件(不改变A2、C2和CA3的量),右图表示反应速度与反应过程的关系,其中表示平衡混合物中CA3的含量最高的一段时间是 。温度为T℃时,将4amolA2和2amolC2放入密闭容器中,充分
反应后测得C2的转化率为50%,则反应的平衡常数 。
(5)化合物A8B4D2有如下转化关系:
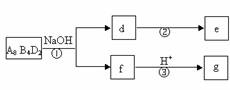
其中,g是常用调味品的主要成分。写出反应①的化学方程式
。
设计实验方案完成d→e的转化
。
查看答案和解析>>
科目:高中化学 来源: 题型:
氮元素是生命活动、物质间转化的常见元素。
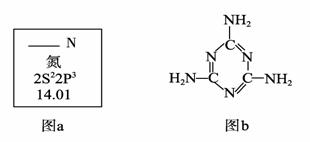
(1)图a是元素周期表中N元素的有关信息,图a中横线上缺失的具体内容是 。
15N是N元素的一种重要核素,其一个原子核中含有的中子数为 。
(2)三聚氰胺的结构简式如上图b,根据你的了解,下列关于三聚氰胺的表述中,
正确的是 (填字母序号)。
A.三聚氰胺的熔点可能很高 B.三聚氰胺的含氮量高达67%左右
C.三聚氰胺属于无机化合物 D.三聚氰胺分子中所有原子在同一平面上
(3)①最近科学家们合成了由氮元素形成的N5n+,电子式![]() 为
为
则n值为 。
②H与N能形成化合物NH5 ,已知该物质与水反应有H2生成,则NH5中含有的化学键为 。
(4)已知M为氮元素与一种金属元素组成的离子化合物,其中金属元素的质量分数为
35.4%,M在汽车安全气囊中有重要的作用。常温下G为淡黄色固体。H为一种常见的液体,A、B、C、X为单质,其中A、C、X为气体,A、X均为空气中成分。I、J为常见的工业原料。

①写出D与X反应的化学方程式
②写出G与H反应的离子方程式 。
③实验室中I应如何保存? 。
④常温下M受撞击时可分解,13gM完全分解为A和B时,放出akJ的热量,写出M分解的热化学方程式 。
⑤M是一种易溶于水的盐,其水溶液显弱碱性,用离子方程式解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为长式周期表的一部分,其中的编号代表对应的元素。

请回答下列问题:
(1)表中属于S区的元素是 (填编号)。
(2)写由上述元素组成的分子中电子总数为10的两种分子: 。
(3)元素①与②组成的化合物中,有一种含6原子分子是重要的化工原料,常把该物质作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 。
A.属于含有极性键的极性分子
B.只含有4个sp-s的σ键和1个p-p的π键
C.该分子中②原子采用sp2杂化
(4)某元素的价电子排布式为nsnnpn+1,该元素原子的核外最外层电子的孤对电子数为 ;该元素与元素①形成的10电子的分子的电子式为 ;

(5)下表为原子序数依次增大的短周期元素A~F的第一到第五电离能数据。
请回答:表中的非金属元素是 (填字母);若E、F为原子序数依次增大的同周期相邻元素,表中显示E比F的第一电离能略大,其原因是
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com