
【题目】400 ℃时,某密闭容器中有X、Y、Z三种气体,从反应开始到达到平衡时各物质浓度的变化如图甲所示(假定反应向正反应方向进行)。图乙为相应时刻仅改变反应体系中某一条件后正、逆反应速率随时间变化的情况。

(1)反应从开始至平衡时v(X)=________________;A、B、C三点的逆反应速率由大到小的顺序为_______________________________________________。
(2)若t3 s时改变的条件是降低压强,则Z物质的起始浓度是________;400 ℃时该反应的平衡常数为________。
(3)t4 s时改变的条件是________,若该反应具有自发性,则此时平衡向________________(填“正反应方向”或“逆反应方向”)移动。
(4)在图乙中绘制出t6 s时向容器中加入一定量X后建立新平衡的过程中(压强保持不变)正、逆反应速率的变化曲线并注明速率类型。____________________
(5)研究表明,该反应经过如下几个阶段:
3X(g)![]() 2Q(s)+P(g) ΔH1 Q(s)===Y(g)+W(g) ΔH2 P(g)+2W(g)
2Q(s)+P(g) ΔH1 Q(s)===Y(g)+W(g) ΔH2 P(g)+2W(g)![]() Z(g) ΔH3
Z(g) ΔH3
试写出X、Y、Z间反应的热化学方程式________________________________________。
【答案】 0.09 mol·L-1·s-1 C>B>A 0.2 mol·L-1 ![]() (或3.33) 升高温度 逆反应方向
(或3.33) 升高温度 逆反应方向 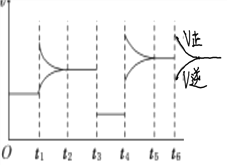 3X(g)
3X(g)![]() 2Y(g)+Z(g) ΔH=ΔH1+2ΔH2+ΔH3
2Y(g)+Z(g) ΔH=ΔH1+2ΔH2+ΔH3
【解析】试题分析:由甲图可知,X是反应物,Y是生成物。10s时反应达到平衡,X、Y的变化量分别为0.9mol/L和0.6mol/L,变化量之比为3:2,由图乙可知,减压后平衡不发生移动,所以该反应的化学方程式为3X2Y+Z。
(1)反应从开始至平衡时v(X)=![]() 0.09 mol·L-1·s-1;浓度越大化学反应速率越大,所以A、B、C三点的逆反应速率由大到小的顺序为C>B>A。
0.09 mol·L-1·s-1;浓度越大化学反应速率越大,所以A、B、C三点的逆反应速率由大到小的顺序为C>B>A。
(2)若t3 s时改变的条件是降低压强,Z的平衡量为0.5mol/L,Z的变化量为0.3mol/L,则Z物质的起始浓度是0.2 mol·L-1;由图甲可知,X、Y、Z的平衡量分别为0.6mol/L、1.2mol/L、0.5mol/L,所以,400 ℃时该反应的平衡常数为![]()
![]() (或3.33)。
(或3.33)。
(3)t4 s时,正反应速率和逆反应速率都增大且增大的程度不同,所以改变的条件是升高温度,若该反应具有自发性,由于该反应的△S<0,所以该反应的△H<0,则此时平衡向逆反应方向(吸热反应方向)移动。
(4)t6 s时向容器中加入一定量X后,因压强保持不变,故容器体积增大,所以X的浓度增大、Y和Z的浓度减小,正反应速率增大、逆反应速率减小,平衡向正反应方向移动,建立新平衡的过程中正、逆反应速率的变化曲线如下:
(5)研究表明,该反应经过如下几个阶段:①3X(g)![]() 2Q(s)+P(g) ΔH1 ;②Q(s)===Y(g)+W(g) ΔH2 ;③P(g)+2W(g)
2Q(s)+P(g) ΔH1 ;②Q(s)===Y(g)+W(g) ΔH2 ;③P(g)+2W(g)![]() Z(g) ΔH3。由①+②
Z(g) ΔH3。由①+②![]() ③可得3X(g)
③可得3X(g)![]() 2Y(g)+Z(g),所以ΔH=ΔH1+2ΔH2+ΔH3, X、Y、Z间反应的热化学方程式为3X(g)
2Y(g)+Z(g),所以ΔH=ΔH1+2ΔH2+ΔH3, X、Y、Z间反应的热化学方程式为3X(g)![]() 2Y(g)+Z(g) ΔH=ΔH1+2ΔH2+ΔH3。
2Y(g)+Z(g) ΔH=ΔH1+2ΔH2+ΔH3。


科目:高中化学 来源: 题型:
【题目】将m1g铜铝合金投入到1 L含H2SO4和HNO3的混合溶液中,合金完全溶解后只生成VL —氧化氮气体(标准状况),向反应后的溶液中逐滴加入1mol/L NaOH溶液,生成沉淀的质量与所加NaOH溶液的体积的关系如下图所示。下列说法中不正确的是:

A. 2c(H2SO4) + c(HNO3) = 0.8 mol·L-1
B. m2—m1=5.1
C. 原合金中铝的质量分数为34.7%
D. V = 2.24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴被誉为战略物资,有出色的性能和广泛的应用。以水钴矿(主要成分为Co2O3、CoO、CuO、Fe2O3、CaO、MgO、NiO和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:

回答下列问题:
Ⅰ.“酸浸”
(1)钴的浸出率随酸浸时间、温度的变化关系如下图所示。综合考虑成本,应选择的最佳工艺条件为_________、_________;滤渣①的主要成分为__________。

(2)Co2O3与浓硫酸反应生成CoSO4,化学方程式为______________________________。
Ⅱ.“净化除杂”分三步完成:
(3)除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12,离子方程式为____________________________________。
(4)除钙、镁:加入适量NaF,当Mg2+恰好完全被除去(离子浓度等于10-5mol·L-1)时,c(Ca2+)=_____________mol·L-1 (取两位有效数字)。已知:Ksp(MgF2)=7.4×10-11,Ksp(CaF2)=1.5×10-10。
(5)除铜:加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,该反应的还原产物为___________。
Ⅲ.“萃取和反萃取”
(6)“水相①”中的主要溶质是Na2SO4和________(写化学式)。
(7)实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol·L-1的CoCl2溶液5L,忽略损耗,钴的产率=______(产率=![]() )。
)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒和镍及其化合物是重要合金材料和催化剂,其储氢合金可作为一种新型锌离子电池的负极材料,该电池以Zn(CF3SO3)2为电解质,以有缺陷的阳离子型ZnMn2O4为电极,成功获得了稳定的大功率电流。
(1)基态钒原子的核外电子排布式为________,其排布时能量最高电子所占据能级的原子轨道有________个伸展方向。
(2)VO2+可与多种物质形成配合物,与氧同周期且第一电离能比氧大的主族元素有____(写元素符号)。
(3)镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为_______,与CN-互为等电子体的一种分子的化学式为__________。
(4)三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF3、H2O2等为主要原料来制取。
①H2O2分子中O原子的杂化方式为________。
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为__________。

(5)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2所示,该晶胞中S2-的配位数为____。
(6)镧镍合金是重要储氢材料,其储氢后的晶胞如图3所示。
①储氢前该镧镍合金的化学式为___________。
②该镧镍合金储氢后氢气的密度为________(用NA表示阿伏加德罗常数的数值)g.cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学实验是科学探究过程中的一种重要方法,掌握化学实验的基本操作和物质的制备、转化及性质的探究尤为重要,请结合所学化学实验知识回答以下问题。
I.实验室配制220mL 1 mol·L-1的稀H2SO4溶液:
(1)用量筒量取浓H2SO4(密度为1.84g·mL-1,质量分数为98%)的体积为________mL。
(2)配制该溶液时需用的主要仪器有量筒、烧杯、玻璃棒、________、________等。
(3)误差下列情况使配制结果偏大的是________。
①溶解后未冷却即转移、定容
②定容时仰视容量瓶刻度线
③用量筒量取一定体积的浓硫酸时俯视
④将量筒、烧杯、玻璃棒洗涤2~3次,转移至容量瓶
II.如图A、B、C是实验室常见的几种气体发生装置:
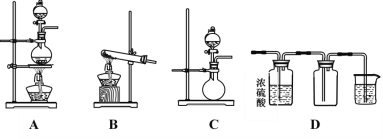
(1)实验室如果用B装置制备氨气,其化学方程式是___________________________。
(2)若想制得干燥的氨气,应选用的干燥剂是_______(填序号,下同)。
①无水CaCl2 ②碱石灰 ③浓硫酸 ④无水CuSO4
(3)若用A装置与D装置相连制备并收集X气体,则X可以是下列气体中的_______。
①CO2 ②NO ③Cl2 ④H2
其中在D装置中连接小烧杯的目的是________________________________。
III.某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
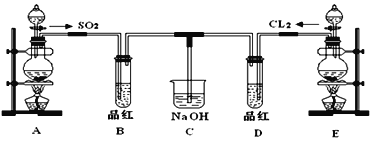
(1)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B:_____________________________,D:________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B:_____________________________,D:________________________。
(2)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________。
(3)若E装置中开始加入200mL 11.8 mol·L-1的浓盐酸和足量的MnO2固体,反应后的混合物经过滤所得溶液,加入足量的AgNO3溶液,所得沉淀的物质的量的范围为_____________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究(NH4)2 SO4 和 NH4HSO4混合物样品组成,称取四份该样品分别逐滴加入相同 浓度的 NaOH 溶液 40.0 mL,加热并完全反应,产生 NH3的体积(已折算成标准状况,
不考虑NH3在水中的溶解)如下表:
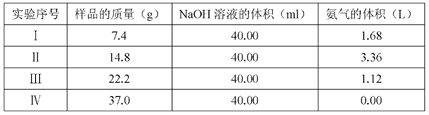
(1)样品中(NH4)2 SO4和NH4HSO4的物质的量之比为_____________。
(2)NaOH 溶液的物质的量浓度为_________________________(精确到0.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔质量为Mg·mol-1的气态化合物VL (已换算成标准状况) 溶于mg 水中,得到溶液的溶质质量分数为ω%,物质的量浓度为cmol·L-1,密度为ρg·cm-3,则下列说法正确的是( )
A. M 可表示为![]() B. c 可表示为
B. c 可表示为![]()
C. ω%可表示为![]() D. ρ可表示为
D. ρ可表示为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是()
A. 铁在潮湿空气中生锈是自发过程
B. 电解池的反应是属于自发反应
C. NH4NO3溶于水吸热,说明其溶于水不是自发过程
D. 非自发反应在任何条件下一定都不能发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图所示(部分反应条件及产物略去)

(1)若A是一种黄色单质固体,则B→C的化学方程式为_______________。浓的D溶液使纸张变黑体现了它的___________性。
(2)若C是红棕色气体,则A化学式可能_________;写出稀的D溶液与铜反应的离于方程式___________________________________________。
(II)工业上治炼铝的原料是铝土(主要成分是A12O3,杂质为Fe2O3、FeO、SiO2等)。某研究小阻设计的提纯A12O3的方案如下

(3)滤液2中含有的溶质有NaOH、______和______(填化学式)。
(4)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2被空气氧化,写出其被氧化的化学方程式___________________________。
(5)写出通入过量CO2生成沉淀A时反应的离子方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com