
【题目】摩尔质量为Mg·mol-1的气态化合物VL (已换算成标准状况) 溶于mg 水中,得到溶液的溶质质量分数为ω%,物质的量浓度为cmol·L-1,密度为ρg·cm-3,则下列说法正确的是( )
A. M 可表示为![]() B. c 可表示为
B. c 可表示为![]()
C. ω%可表示为![]() D. ρ可表示为
D. ρ可表示为![]()
【答案】D
【解析】
A.VL气体在标准状况下的物质的量为V/22.4mol,故气体的质量为VM/22.4g,溶液的质量为(m+ VM/22.4)g,溶液的质量分数为ω%=[(VM/22.4)/(m+ VM/22.4)]×100%,整理得M=22.4m×ω%/(1-ω%)V,故A错误;
B. VL气体在标准状况下的物质的量为V/22.4mol,故气体的质量为VM/22.4g,溶液的质量为(m+ VM/22.4)g,溶液的体积为(m+ VM/22.4)g/1000ρg/L= VM+22.4m/22400L,故c=(1000ρv/ VM+22.4m)mol/L,故B错误;
C.根据A项分析,ω%=[(VM/22.4)/(m+ VM/22.4)]×100%=100ρv/MV+22.4m%,故C错误;
D.根据c=1000ρw/M可知,密度ρ=![]() ,故D正确;
,故D正确;
故选D。


科目:高中化学 来源: 题型:
【题目】下列实验中,对应的现象及结论或解释均正确的是
选项 | 实验操作 | 现象 | 结论或解释 |
A | 向氢氧化铁胶体中滴加硫酸钠溶液 | 有红褐色沉淀 | 胶体遇强电解质聚沉 |
B | 将SO2通入紫色石蕊溶液中 | 溶液先变红后褪色 | SO2具有漂白性 |
C | 将灼烧至红热的铜丝插入乙醇中 | 铜丝由黑变红 | 乙醇被还原 |
D | 向氯化铝溶液中持续通入氨气 | 产生白色沉淀后溶解 | Al(OH)3与碱反应 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛酸钡(BaTiO3)在工业上有重要用途,主要用于制作电子陶瓷、PTC热敏电阻、电容器等多种电子元件。以下是生产钛酸钡的一种工艺流程图:
![]()
已知:①草酸氧化钛钡晶体的化学式为BaTiO(C2O4)2·4H2O;
②25℃时,BaCO3的溶度积Ksp=2.58×10-9;
(1)BaTiO3中Ti元素的化合价为:__________。
(2)用盐酸酸浸时发生反应的离子方程式为: __________。
(3)流程中通过过滤得到草酸氧化钛钡晶体后,为提高产品质量需对晶体洗涤。
①过滤操作中使用的玻璃仪器有_____________________。
②如何证明晶体已洗净?_______________________。
(4)TiO2具有很好的散射性,是一种有重要用途的金属氧化物。工业上可用TiCl4水解来制备,制备时需加入大量的水,同时加热,其目的是:_______________。
(5)某兴趣小组取19.70gBaCO3模拟上述工艺流程制备BaTiO3,得产品13.98g,BaTiO3的产率为:________。
(6)流程中用盐酸酸浸,其实质是BaCO3溶解平衡的移动。若浸出液中c(Ba2+)=0.1mol/L,则c(CO32-)在浸出液中的最大浓度为__________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】400 ℃时,某密闭容器中有X、Y、Z三种气体,从反应开始到达到平衡时各物质浓度的变化如图甲所示(假定反应向正反应方向进行)。图乙为相应时刻仅改变反应体系中某一条件后正、逆反应速率随时间变化的情况。

(1)反应从开始至平衡时v(X)=________________;A、B、C三点的逆反应速率由大到小的顺序为_______________________________________________。
(2)若t3 s时改变的条件是降低压强,则Z物质的起始浓度是________;400 ℃时该反应的平衡常数为________。
(3)t4 s时改变的条件是________,若该反应具有自发性,则此时平衡向________________(填“正反应方向”或“逆反应方向”)移动。
(4)在图乙中绘制出t6 s时向容器中加入一定量X后建立新平衡的过程中(压强保持不变)正、逆反应速率的变化曲线并注明速率类型。____________________
(5)研究表明,该反应经过如下几个阶段:
3X(g)![]() 2Q(s)+P(g) ΔH1 Q(s)===Y(g)+W(g) ΔH2 P(g)+2W(g)
2Q(s)+P(g) ΔH1 Q(s)===Y(g)+W(g) ΔH2 P(g)+2W(g)![]() Z(g) ΔH3
Z(g) ΔH3
试写出X、Y、Z间反应的热化学方程式________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程,下列有关说法正确的是
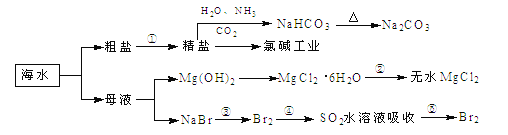
A. 制取NaHCO3的反应是利用其溶解度小于NaCl和NH4Cl
B. ①粗盐提纯中除去杂质离子Mg2+、Ca2+、SO42-时,必须先除Ca2+后除SO42-
C. 在工段③、④、⑤中,溴元素均被氧化
D. 工业上通过电解饱和MgCl2溶液制取金属镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下的固定容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g),其浓度与时间的关系如下表。下列说法错误的是( )
2SO3(g),其浓度与时间的关系如下表。下列说法错误的是( )

A. 0 min时正反应速率最大,逆反应速率为零
B. 0~40 min内,正反应速率大于逆反应速率
C. 50 min时达到了化学平衡,此时正反应速率等于逆反应速率
D. 50 min及以后的时间内,都处于平衡状态,反应物和生成物的浓度不再发生变化,反应停止了
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各种仪器:①漏斗②容量瓶③表面皿④分液漏斗⑤天平⑥量筒⑦胶头滴管⑧蒸馏烧瓶。常用于物质分离的是( )
A.①③⑦B.②⑥⑦
C.①④⑧D.④⑥⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com