
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
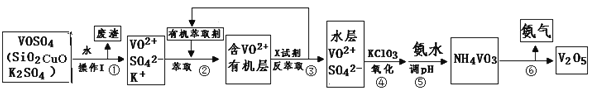
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+ 2nHA(有机层)![]() 2RAn(有机层)+ nH2SO4(水层)
2RAn(有机层)+ nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 0 | 1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。〖已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39〗
(5)该工艺流程中,可以循环利用的物质有 和 。
【答案】(1)SiO2过滤
(2)加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率 H2SO4
(3)NH3·H2O+VO3-=NH4VO3↓+OH-
(4)1.7~1.8(或1.7、1.8其中一个)2.6×10-3mol·L-1
(5)氨气(或氨水)有机萃取剂
【解析】
试题分析:(1)加水溶解后二氧化硅不溶于水,因此过滤得到滤渣的主要成分为二氧化硅;操作I的名称是过滤;
(2)②中萃取时必须加入适量碱,分析平衡R2(SO4)n (水层)+2nHA(有机层)![]() 2RAn(有机层)+nH2SO4 (水层)可知,加入的碱会和平衡中的氢离子反应促进平衡正向进行,提高钒的萃取率;
2RAn(有机层)+nH2SO4 (水层)可知,加入的碱会和平衡中的氢离子反应促进平衡正向进行,提高钒的萃取率;
③中反萃取时加入的X试剂是抑制平衡正向进行,可以加入硫酸抑制平衡正向进行;
(3)⑤中是氨水与VO3-反应,反应的离子方程式为NH3·H2O+VO3-=NH4VO3↓+OH-;
(4)根据表中数据判断,⑤中加入氨水,调节溶液pH最佳值为1.7~1.8,此时钒沉淀率达到最大,需要氨水量较小;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,此时pH=2,c(H+)=0.01mol/L,c(OH-)=10-12mol/L,则溶液中c(Fe3+)浓度依据溶度积计算,即Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=2.6×10-39,解得c(Fe3+)=2.6×10-3molL-1,不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<2.6×10-3molL-1;
(5)分析流程图,物质参加反应,反应过程中又生成的物质,重复利用的物质可以循环利用,流程中有机萃取剂、氨气可以循环利用。


科目:高中化学 来源: 题型:
【题目】某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
(1)请将Au2O3之外反应物与生成物分别填入以下空格内。
![]()
(2)反应中,被还原的元素是____________,还原剂是____________。
(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。
![]()
(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一块铁的“氧化物”样品,用140mL5.0mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025molCl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为( )
A. Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有0.1 mol Na2O和 Na2O2的混合物,溶于水后刚好被100 g 7.3﹪的盐酸中和,则混合物中Na2O和 Na2O2的物质的量之比为
A.11﹕1 B.2﹕1 C.3﹕4 D.任意比
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四个等体积的干燥圆底烧瓶中分别充满 ①NH3 ② HCl ③ NO2 ④ 以体积比4:1混合的NO2和O2 的混合气体,进行喷泉实验,如图所示,经充分反应后,瓶内溶液的物质的量浓度大小关系为 ( )
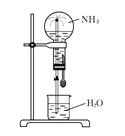
A.①> ② >③ > ④
B.①= ② =③= ④
C.① = ② = ③ > ④
D.① = ② > ③ > ④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯和苯的叙述中,错误的是( )
A. 乙烯能使溴的四氯化碳溶液褪色 B. 乙烯可以燃烧
C. 苯能使酸性高锰酸钾溶液褪色 D. 苯可以燃烧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(填元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)沸点:H2Y H2S(填“>”或“=”或“<”),理由是 。
(5)Y2和Y3互为 (填“同位素”或“同分异构体”或“同素异形体”)。

(6)其中单质Y2可用做下图所示装置(燃料电池)的氧化剂,请写出Y2在酸性电解质溶液中发生的电极反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cl2和H2置于0.5L密闭容器中,反应20 s后,生成2.0molHCl。在这段时间内,用HCl浓度变化表示的平均反应速率为( )
A.20mol·(L·min)-1 B.0.1mol·(L·s)-1
C.0.2mol·(L·s)-1 D.0.4mol·(L·min)-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com