
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(填元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)沸点:H2Y H2S(填“>”或“=”或“<”),理由是 。
(5)Y2和Y3互为 (填“同位素”或“同分异构体”或“同素异形体”)。

(6)其中单质Y2可用做下图所示装置(燃料电池)的氧化剂,请写出Y2在酸性电解质溶液中发生的电极反应方程式 。
【答案】(1)第三周期VIIA族;
(2)Si;(3)ac
(4)>;H2O分子间有氢键,氢键比分子间作用力强
(5)同素异形体;
(6)O2+ 4e- + 4H+= 2H2O
【解析】试题分析:(1)周期表中Z元素为氯元素,核电荷数为17,三个电子层,最外层7个电子,位于周期表中第三周期,第ⅤⅡA族,故答案为:第三周期,第ⅤⅡA族;
(2)表中元素为第二周期和三周期中的元素,依据同周期原子半径依次减小,同主族原子半径依次增大分析可知,元素的原子半径最大的是Si,故答案为:Si;
(3)a.Y单质与H2S溶液反应,溶液变浑浊,说明氧气的氧化性比硫强,则说明Y元素的非金属性比S元素的非金属性强,故a正确;b.在氧化还原反应中,1molY单质比1molS得电子多,氧化性强弱与得失电子数没有必然关系,故b错误;c.元素的非金属性越强,氢化物的稳定性越强,Y和S两元素的简单氢化物受热分解,前者的分解温度高,说明Y的非金属性较强,故c正确;故答案为:ac;
(4)H2O分子间有氢键,氢键比分子间作用力强,乙醇沸点:H2O>H2S,故答案为:>;H2O分子间有氢键,氢键比分子间作用力强;
(5)O2和O3都是氧元素构成的单质,互为同素异形体,故答案为:同素异形体;
(6)O2在酸性电解质溶液中发生的电极反应方程式为O2+ 4e- + 4H+= 2H2O,故答案为:O2+ 4e- + 4H+= 2H2O。


科目:高中化学 来源: 题型:
【题目】右图为实验室某盐酸试剂瓶标签上的有关数据,是根据标签上的有关数据回答下列问题:
试根据标签上的有关数据回答下列问题:

⑴该浓盐酸中HCl的物质的量浓度为___________mol·L-1。
⑵取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_________。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制500 mL物质的量浓度为0.40 mol/L的稀盐酸。
①容量瓶上需标有以下五项中的_________
A.温度 B.浓度 C.容量 D.压强 E.刻度线
②将下列操作填写完整,并排列其正确的操作顺序______________(字母表示,每个字母只能用一次);
A.用量筒准确量取浓盐酸___________ml,注入烧杯中,加入少量水(约30ml),用玻璃棒慢慢搅拌,使其混合均匀;
B.用30ml水洗涤烧杯2~3此,洗涤液均注入容量瓶,振荡;
C.将已冷却的盐酸沿玻璃棒注入___________中;
D.将容量瓶盖紧,颠倒摇匀;
E.改用_______加水,使溶液凹液面恰好与刻度线相切;
F.继续往容量瓶内小心加水,直到液面至刻度线下_________处。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
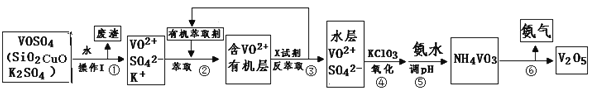
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):R2(SO4)n (水层)+ 2nHA(有机层)![]() 2RAn(有机层)+ nH2SO4(水层)
2RAn(有机层)+ nH2SO4(水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)⑤的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 0 | 1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。〖已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39〗
(5)该工艺流程中,可以循环利用的物质有 和 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是

A.绿原酸的分子式为C16H8O9
B.1mol绿原酸最多与7mol NaOH反应
C.绿原酸是芳香族化合物
D.绿原酸分子中有4种化学环境不同的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定质量的某物质在ag氧气中完全燃烧,将其产物跟足量的过氧化钠固体完全反应,反应后容器内有bg氧气,测得b>A.下列物质中满足上述结果的是
A.HCOOH B.HCHO C.CH4 D.C6H12O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为进一步提高合成氨的生产能力,科研中最有开发价值的是 ( )。
A.研制高温下活性较大的催化剂
B.寻求氮气的新来源
C.研制低温下活性较大的催化剂
D.研制耐高温和高压的新材料建造合成塔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的生成物不受反应物的用量或浓度或反应条件影响的是( )
A. SO2与NaOH溶液反应 B. Na与O2的反应
C. Cu在S蒸气中燃烧 D. Fe粉加入HNO3中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机自然界中最丰富的元素是O、Si、Al、Fe,而生物体的细胞中含量最多的4种元素是C、H、O、N,这说明生物界和非生物界具有 ( )
A. 多样性 B. 分割性
C. 统一性 D. 差异性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素推断题:
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第 周期,第 族。
(2)X可形成双原子分子,其分子的电子式是 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为 (填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为 。
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式 。
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com