
【题目】元素推断题:
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第 周期,第 族。
(2)X可形成双原子分子,其分子的电子式是 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为 (填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为 。
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式 。
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为 。
【答案】(1)三VIIA(2)![]() H3O+ HS-
H3O+ HS-
(3)2S2Cl2+2H2O=3S↓+SO2↑+4HCl
(4)2SO2(g)+O2(g)![]() 2SO3(g)△H=-190.0kJmol-1
2SO3(g)△H=-190.0kJmol-1
【解析】试题分析:由短周期元素X、Y、Z、W在元素周期表中的位置,可知X、Y处于第二周期,Z、W处于第三周期,Y原子的最外层电子数是其电子层数的3倍,最外层电子数为6,故Y为O元素,可推知X为N元素、Z为S元素、W为Cl。
(1)W为Cl元素,处于周期表中第三周期第ⅦA族;
(2)氮气的电子式是![]() ;氧和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+;硫和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
;氧和氢元素形成的10电子微粒中常见的+1价阳离子为H3O+;硫和氢元素形成的18电子微粒中常见的-1价阴离子为HS-;
(3)该物质可与水反应生成一种能使品红溶液褪色的气体,该气体是SO2,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该元素应该是S,S2Cl2中S元素的化合价是+1价,所以其还原产物是S,则反应的化学方程式为2S2Cl2+2H2O=3S↓+SO2↑+4HCl;
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,达平衡时有三种气态物质,反应方程式为:2SO2+O2![]() 2SO3,反应时,每转移4mol电子放热190.0kJ,则参加反应二氧化硫为4mol÷2=2mol,该反应的热化学方程式是2SO2(g)+O2(g)
2SO3,反应时,每转移4mol电子放热190.0kJ,则参加反应二氧化硫为4mol÷2=2mol,该反应的热化学方程式是2SO2(g)+O2(g)![]() 2SO3(g)△H=-190.0kJmol-1。
2SO3(g)△H=-190.0kJmol-1。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(填元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)沸点:H2Y H2S(填“>”或“=”或“<”),理由是 。
(5)Y2和Y3互为 (填“同位素”或“同分异构体”或“同素异形体”)。

(6)其中单质Y2可用做下图所示装置(燃料电池)的氧化剂,请写出Y2在酸性电解质溶液中发生的电极反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cl2和H2置于0.5L密闭容器中,反应20 s后,生成2.0molHCl。在这段时间内,用HCl浓度变化表示的平均反应速率为( )
A.20mol·(L·min)-1 B.0.1mol·(L·s)-1
C.0.2mol·(L·s)-1 D.0.4mol·(L·min)-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种重要的化工原料,标况下密度1.25 g/L;C是一种酸性物质,D是具有果香气味的烃的衍生物。A、B、C、D在一定条件下存在如下转化关系(石蜡油含17个碳原子以上的液态烷烃,部分反应条件、产物被省略)。
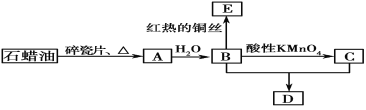
写出下列变化的化学方程式并指出反应类型:
①A→B:_____________________;
②B+C→D: __ ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】材料与人类生活密切相关。下列物品与对应的材料相匹配的是( )
A.光导纤维——硅酸盐材料
B.透明饮料瓶——合金材料
C.纯棉织物——合成纤维材料
D.橡胶轮胎——有机高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较,不能用元素周期律解释的是
A. 金属性:Na>Mg B. 酸性:H2SO4>H2SiO3
C. 稳定性:HCl> HBr D. 同浓度溶液的碱性:Na2CO3> NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小刚与同龄儿童相比,身体明显偏矮、偏瘦。在医院检查后发现血淸中锌的含量过低。对此解释不正确的是
A. 锌是人体必需的化学元素
B. 锌是人体必需的微量元素
C. 锌在人体的生长发育过程中的作用不可替代
D. 锌的作用大,人体正常生长发育需大量补充锌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A. 碱石灰具有吸水性,可用于干燥氯气
B. 甲醛能使蛋白质变性,可以用于食品防腐剂
C. 炭具有强还原性,常用于冶炼钠、钾等金属
D. 碳酸氢钠溶液具有弱碱性,可用于制胃酸中和剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】

(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)某学生欲用该浓盐酸和蒸馏水配制成1mol·L-1的稀盐酸。现实验室仅需要这种盐酸220mL,试回答下列问题:
①经计算需要______mL浓盐酸,在量取时宜选用下列量筒中的______。
A.5mL |
B.10mL |
C.25mL |
D.50mL |
②在量取浓盐酸后,进行了下列操作:
a等稀释的盐酸的温度与室温一致后,沿玻璃棒注入容量瓶中。
b往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
c在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
d用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)____________。若量取的是浓硫酸,简述第c步实验的操作过程。
③在上述配制过程中,用量筒量取浓盐酸时仰视观察凹液面,其配制的稀盐酸浓度________(填“偏高”、“偏低”或“无影响”,下同)。若定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线,则配制的稀盐酸浓度________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com