
【题目】关于各图的说法(其中①③④中均为情性电极)正确的是( )
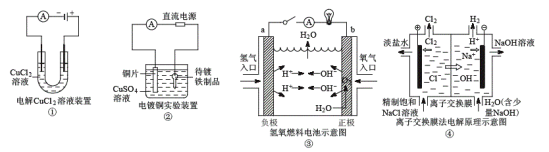
A.①装置中阴极处产生的气体能够使湿润KI淀粉试纸变蓝
B.②装置中待镀铁制品应与电源正极相连
C.③装置中电子由b极流向a极
D.④装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】一般硫粉含有S(单斜)和S(正交)两种同素异形体。已知常温下:
S(S,单斜)+O2(g)![]() SO2(g)+297.16 kJ;
SO2(g)+297.16 kJ;
S(S,正交)+O2(g)![]() SO2(g)+296.83 kJ
SO2(g)+296.83 kJ
下列说法正确的是
A.S(g)+O2(g)![]() SO2(g)+Q3 Q3>297.16 kJ
SO2(g)+Q3 Q3>297.16 kJ
B.单斜硫和正交硫互为同分异构体
C.常温下单斜硫比正交硫稳定
D.单斜硫转化为正交硫的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用如图装置进行“氨的催化氧化及检验产物”实验(图中夹持装置已略去)。下列推断合理的是( )
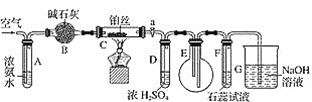
A.C不需要持续加热
B.D的作用是干燥气体
C.B是无用装置
D.仅用该套装置和药品无法达到检验产物的目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铟产业被称为“信息时代的朝阳产业”。元素周期表中铟的数据见图,下列说法完全正确的是
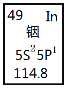
A.铟元素的质量数是114.8
B.铟元素的相对原子质量是115,中子数为66
C.铟元素是一种主族元素,位于第五周期第ⅢA族
D.铟原子最外层有3个能量相同的电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分(1~36号元素),对比中学常见元素周期表思考扇形元素周期表的填充规律,下列说法不正确的是
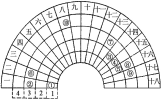
A.⑥、⑧、⑨对应原子的半径依次减小
B.②、⑦的最高价氧化物对应的水化物能相互反应
C.元素⑩为Fe元素,处于常见周期表第四周期第VIIIB族
D.①可分别与③、④、⑤均可形成既含极性键又含非极性键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空
(1)对于Fe+2HCl===FeCl2+H2↑,改变下列条件对生成氢气的速率有何影响?(填“增大”、“减小”或“不变”)
①升高温度:________;
②增加盐酸体积:____________;
③加入等体积的NaCl溶液:__________;
④滴入几滴CuSO4溶液:____________;
(2)一定温度下,反应N2(g)+O2(g) ===2NO(g)在密闭容器中进行,回答下列措施对化学反应速率的影响。(填“增大”、“减小”或“不变”)
①缩小体积使压强增大:__________;
②恒容充入N2:__________;
③恒压充入He:__________。
(3)在恒温恒容条件下,可逆反应A(g)+B(g) C(g)+D(g)。判断该反应是否达到平衡的依据为__________(填正确选项前的字母)
a.压强不随时间改变
b.气体的密度不随时间改变
c.c(A)不随时间改变
d.单位时间里生成C和D的物质的量相等
(4)一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示:
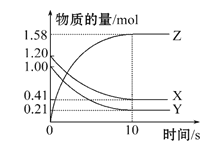
①从反应开始到10 s时,用Z表示的反应速率为________,X的物质的量浓度减少了________,Y的转化率为________。
②该反应的化学方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅是一种金属元素,可用作耐酸腐蚀、蓄电池等的材料。其合金可作铅字、轴承、电缆包皮之用,还可做体育运动器材铅球等。
(1)铅元素位于元素周期表第六周期IVA。IVA中原子序数最小的元素的原子有_______种能量不同的电子,其次外层的电子云有_______种不同的伸展方向。
(2)与铅同主族的短周期元素中,其最高价氧化物对应水化物酸性最强的是______(填化学式),气态氢化物沸点最低的是_____________(填化学式)。
(3)配平下列化学反应方程式,把系数以及相关物质(写化学式)填写在空格上, 并标出电子转移的方向和数目。
__PbO2+___MnSO4+___HNO3 →___HMnO4+___Pb(NO3)2+___PbSO4↓+____ ____
(4)把反应后的溶液稀释到1 L,测出其中的Pb2+的浓度为0.6 mol·L-1,则反应中转移的电子数为_______个。
(5)根据上述反应,判断二氧化铅与浓盐酸反应的化学方程式正确的是_______
A. PbO2+4HCl→PbCl4+2H2O B. PbO2+4HCl→PbCl2+ Cl2↑+2H2O
C. PbO2+2HCl+2H+→PbCl2+2H2O D. PbO2+4HCl→PbCl2+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饱和二氧化硫水溶液中存在下列平衡体系:SO2+H2O![]() H++HSO3﹣ HSO3﹣
H++HSO3﹣ HSO3﹣![]() H++SO32﹣,若向此溶液中( )
H++SO32﹣,若向此溶液中( )
A.加水,SO32﹣浓度增大
B.通入少量Cl2气体,溶液pH增大
C.加少量CaSO3粉末,HSO3﹣浓度基本不变
D.通入少量HCl气体,溶液中HSO3﹣浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2与Cl2的氧化性相近,常温下均为气体,在自来水消毒和果蔬保鲜等方面应用广泛某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究
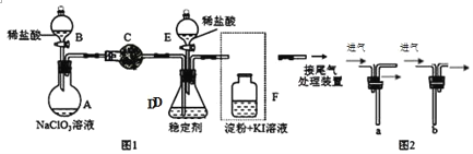
(1)仪器C的名称是:___安装F中导管时,应选用图2中的:___(填“a”或“b”)。
(2)打开B的活塞,A中氯酸钠和稀盐酸混和产生Cl2和ClO2,写出反应化学方程式:___;为使ClO2在D中被稳定剂充分吸收,可采取的措施是___
(3)关闭B的活塞,ClO2在D中被稳定剂完全吸收生成NaClO2,此时F中溶液的颜色不变,则装置C的作用是:___。
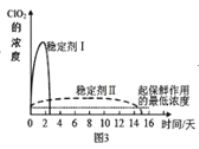
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,该反应的离子方程式为:___,在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是:___
(5)已吸收ClO2气体的稳定剂Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如图3所示,若将其用于水果保鲜,你认为效果较好的稳定剂是___,(选填“I”或“II”)理由是:___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com