
����Ŀ����Ҫ�����
��1������Fe��2HCl===FeCl2��H2�����ı��������������������������к�Ӱ�죿(����������������С������������)
�������¶ȣ�________��
���������������____________��
�ۼ���������NaCl��Һ��__________��
�ܵ��뼸��CuSO4��Һ��____________��
��2��һ���¶��£���ӦN2(g)��O2(g) ===2NO(g)���ܱ������н��У��ش����д�ʩ�Ի�ѧ��Ӧ���ʵ�Ӱ�졣(����������������С������������)
����С���ʹѹǿ����__________��
�ں��ݳ���N2��__________��
�ۺ�ѹ����He��__________��
��3���ں��º��������£����淴ӦA(g)��B(g) C(g)��D(g)���жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ__________(����ȷѡ��ǰ����ĸ)
a��ѹǿ����ʱ��ı�
b��������ܶȲ���ʱ��ı�
c��c(A)����ʱ��ı�
d����λʱ��������C��D�����ʵ������
��4��һ���¶��£���2 L���ܱ������У�X��Y��Z�������������ʱ��仯��������ͼ��ʾ��
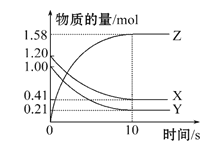
�ٴӷ�Ӧ��ʼ��10 sʱ����Z��ʾ�ķ�Ӧ����Ϊ________��X�����ʵ���Ũ�ȼ�����________��Y��ת����Ϊ________��
�ڸ÷�Ӧ�Ļ�ѧ����ʽΪ_________________________________________��
���𰸡����� ���� ��С ���� ���� ���� ��С c 0.079 mol��L��1��s��1 0.395 mol��L��1 79% ![]()
��������
��1���٣������¶ȣ���λ����ڷ�Ӧ���������Լ���Ч��ײƵ�����ӣ���ѧ��Ӧ��������
�ʴ�Ϊ������
�ڣ����������������λ����ڷ�Ӧ�����������䣬��Ч��ײƵ�ʲ��䣬��ѧ��Ӧ���ʲ��䣬
�ʴ�Ϊ�����䣻
�ۣ�NaCl���μӻ�ѧ��Ӧ������NaCl��Һ�൱�ڼ���ˮ����Һ������ӣ���λ����ڻ��������С����Ч��ײƵ�ʽ���С����ѧ��Ӧ���ʼ�С��
�ʴ�Ϊ����С��
�ܣ�����CuSO4��Һ����������Cu2+>H+����Cu2+����Fe�����û���Ӧ����Cu����Һ���γ���Fe-����-Cuԭ��أ����ӿ컯ѧ��Ӧ���ʣ�
�ʴ�Ϊ������
��2���٣�����ѹǿ����λ����ڻ���������ӣ���Ч��ײƵ�����ӣ���ѧ��Ӧ��������
�ʴ�Ϊ������
�ڣ�����N2��Ӧ��Ũ�����ӣ���λ����ڻ������������Ч��ײƵ�����ӣ���ѧ��Ӧ��������
�ʴ�Ϊ������
�ۣ���ѹ����He��He���μӻ�ѧ��Ӧ���������������λ����ڻ��������С����Ч��ײƵ�ʼ�С����ѧ��Ӧ���ʼ�С��
�ʴ�Ϊ����С��
��3���÷�Ӧ��������������Ӧ����Ӧ��ȫ��Ϊ���壻
a����Ӧ�ں��������н��У���������ʵ���֮�ȵ�����ѹǿ֮�ȣ��÷�ӦΪ����������Ӧ����Ӧ�����У����������ʵ������䣬ѹǿ���䣬�����жϷ�Ӧ�Ƿ���ƽ��״̬����a���������⣻
b����Ӧ�����У��������������䣬������������䣬���������ܶȲ��䣬�����жϷ�Ӧ�Ƿ���ƽ��״̬����b���������⣻
c����Ӧ�����У�A��Ũ�Ȳ������ñ䣬˵�����淴Ӧ������ȣ���˵����Ӧ�ﵽƽ��״̬����c�������⣻
d����C��D�Ļ�ѧ��������ȣ�����ڷ�Ӧ�����У���λʱ��������C��D�����ʵ���һ����ȣ������жϷ�Ӧ�Ƿ���ƽ��״̬����d���������⣻
�ʴ�Ϊ��c��
��4���٣��ӷ�Ӧ��ʼ��10sʱ��Z����������1.58mol�����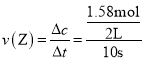 =0.079 mol��L��1��s��1����ͼ���֪��
=0.079 mol��L��1��s��1����ͼ���֪��![]() =0.395 mol��L��1��
=0.395 mol��L��1��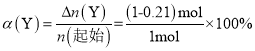 =79%��
=79%��
�ʴ�Ϊ��0.079 mol��L��1��s��1��0.395 mol��L��1��79%��
�ڣ���ͼ���֪����Ӧ�����У�Z�����ʵ��������ӣ�X��Y�����ʵ����ڼ��٣���ZΪ�����X��YΪ��Ӧ�10s�����ʵ����ʵ������ٷ����仯���ҷ�Ӧ���δ������ȫ���ʸ÷�ӦΪ���淴Ӧ��![]() ���ʸ÷�Ӧ�Ļ�ѧ����ʽΪ��
���ʸ÷�Ӧ�Ļ�ѧ����ʽΪ��![]()
�ʴ�Ϊ��![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ӵ���һ�ֺϳɹ�����ά�ĵ��壬�ṹ��ʽ��ͼ���йؽ��Ӵ���˵������ȷ����
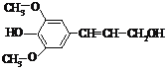
A.����3 mol NaOH��Һ��Ӧ
B.��ͨ����Ũ��ˮ�ķ�Ӧ֤�����ڷ��ǻ�
C.�ܷ����ķ�Ӧ������������ȡ�����ӳ�
D.�����Ʒ�Ӧ��������̼���ƺ�̼�����Ʒ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ӧ�ù㷺������ɫ���������������������ȶ������Ի��������������ֽ⣮��գ�
��1����������ķ��ӽṹ��ͼ�����������������__������/�Ǽ��ԣ����ӣ���ȥ����������Ϊ��������ķ��ӽṹҲ�����ǣ���ѡ�����ʵ�鷽��֤����������ķ��ӽṹΪ����__��ѡ���ţ���
a���ⶨ��������ķе�
b���ⶨ��������ֽ�ʱ�����յ�����
c���ⶨ����������H��O��O��O�ļ���
d���۲��������ϸ���Ƿ��ڵ糡��ƫת
Na2O2��K2O2�Լ�BaO2���������������ɹ������⣮ʵ���ҿ���ϡ��������������ñ���ȴ�������·�Ӧ��ȡ�������⣮
��2�������������������ʺϵ���__����Ӧ��Ϻ�__����������ƣ����ɵõ�˫��ˮ��
��3������Ӧʱû���ñ���ȴ���������������д����Ӧ�Ļ�ѧ����ʽ__�������Ը��������Һ�ζ�˫��ˮ�ķ������Բⶨ˫��ˮ��Ũ�ȣ�
��4��ȡ5.00mL ˫��ˮ��Ʒ�����Ƴ�250mL��Һ����ʵ����̱����õ���������Ҫ����Ϊ__�����������ƣ���
��5��ȡ25.00mL������Һ����0.020mol/L�����Ը��������Һ�ζ�������__������ζ��յ㣬���ĸ��������Һ15.50mL����ԭ˫��ˮ��Ʒ�к���������__ g/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
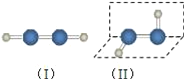
����Ŀ�����ڿ��淴Ӧ2AB3��g��![]() 2A��g��+3B2��g�� ��H��0������ͼ����ȷ���ǣ� ��
2A��g��+3B2��g�� ��H��0������ͼ����ȷ���ǣ� ��
A. B.
B.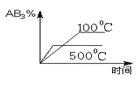
C. D.
D.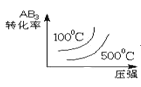
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڸ�ͼ��˵�������Т٢ۢ��о�Ϊ���Ե缫����ȷ���ǣ� ��
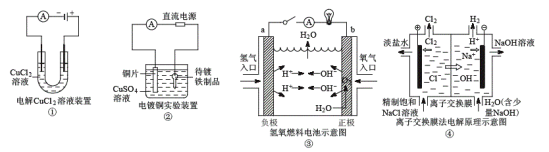
A.��װ���������������������ܹ�ʹʪ��KI������ֽ����
B.��װ���д�������ƷӦ���Դ��������
C.��װ���е�����b������a��
D.��װ���е����ӽ���Ĥ���Ա������ɵ�Cl2��NaOH��Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� ( )
��O2��O3��O2����O22����Ϊͬ��������
����ϩ����Ȳ��Ϊͬϵ��
��35Cl��37Cl��Ϊͬλ��
������![]() ���ǻ���ȩ
���ǻ���ȩ![]() ��Ϊͬ���칹��
��Ϊͬ���칹��
A.�٢�B.�ڢ�C.�٢�D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2��һ�ָ�Ч�����ס���ȫ��ɱ������������������ˮ���Ʊ��������£�
��1��������ʳ��ˮ�Ʊ������ơ����ڵ���ʳ��ˮ���ȳ�ȥ���е� Ca2+��Mg2+��SO42-�����ʡ��ڳ��Ӳ���ʱ��������ˮ���ȼ��������________���ѧʽ�������������ٲ������ټ��������________��NaOH����ַ�Ӧ����һ����ȥ��
��2������������õ���ʳ��ˮ���ض������µ��õ������ƣ�NaClO3�����ٽ��������ᷴӦ����ClO2��Cl2��ClO2��Cl2�����ʵ�������____________��
��3��ѧ����������ͼ��ʾװ��ģ�ҵ��ȡ���ռ�ClO2����NaClO3�Ͳ��ᣨH2C2O4��������60�� ʱ��Ӧ�Ƶá�

��Ӧ��������Ҫ��A�������м��ȣ����ȵķ�ʽΪ____________��������Ҫ�IJ����������ƾ����⣬����_________________��
��4����Ӧ����װ��C�пɵ��������ƣ�NaClO2����Һ����֪NaClO2������Һ���¶ȵ���38��ʱ�������ľ�����NaClO2��3H2O�����¶ȸ���38��ʱ��������NaClO2����������ͼ��ʾNaClO2���ܽ�����ߣ�����ɴ�NaClO2��Һ���Ƶ�NaClO2��3H2O�IJ������裺
��_____________����_______________����ϴ�ӣ��ܸ��
��5��Ŀǰ�ҹ��ѳɹ����Ƴ�����NaClO2��ȡ�������ȵ��·�������Cl2ͨ�뵽NaClO2��Һ�С�����ȡ270kg�������ȣ���Ҫ�������Ƶ�������________��
��6��ClO2��Cl2���ܽ���Ʒ�ˮ�еľ綾CN-����Ϊ�����ʣ���������ԭΪCl-��������CN-��ͬ���ĵ�Ʒ�ˮ������Cl2�����ʵ�����ClO2��_______����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ��PtΪ�缫������ȼ�ϵ�صĹ���ԭ��ʾ��ͼ��ϡH2SO4��ҺΪ�������Һ�������й�˵������ȷ����

A. a��Ϊ������������a�������·����b��
B. a���ĵ缫��Ӧʽ��H2��2e��===2H��
C. ��ع���һ��ʱ���װ����c(H2SO4)����
D. ����H2��ΪCH4�����ĵ����ʵ�����CH4ʱ��O2����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ת����ϵ���ش����⣺

��֪������CH3Br![]() CH3��HBr��
CH3��HBr��
��C���ʱ�����һ±����ֻ�����֡�
(1)д��B���ʵ�����__________��D���ʵĽṹ��ʽ________��
(2)д����Ӧ��������________����Ӧ��������________��
(3)д����Ӧ���Ļ�ѧ����ʽ��________________________________��
(4)д��D��E��Ӧ�Ļ�ѧ����ʽ��_______________��
(5)��Ӧ�����п�������һ��C16H18���л���䱽����һ±����Ҳֻ�����֣�д�����Ľṹ��ʽ��_______________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com