
【题目】纳米级Cu2O是优良的催化剂和半导体材料,工业上常用下列方法制备Cu2O。
(1)热还原法
加热条件下,用液态肼(N2H4)还原新制的Cu(OH)2制备Cu2O,同时放出N2。该反应的化学方程式为。
(2)电解法 以氢氧燃料电池为电源,用电解法制备Cu2O的装置如图。
①A的化学式为。
②燃料电池中,OH-的移动方向为(填“由左向右”或“由右向左”);电解池中,阳极的电极反应式为。
③电解一段时间后,欲使阴极室溶液恢复原来组成,应向其中补充一定量 (填化学式)。
④制备过程中,可循环利用的物质为(填化学式)。
(3)干法还原法
利用反应Cu +CuO ![]() Cu2O制备Cu2O。将反应后的均匀固体混合物(含有三种成分)等分为两份,一份与足量H2充分反应后,固体质量减少6.4g;另一份恰好溶于500mL稀硝酸,生成标准状况下4.48LNO,该稀硝酸的物质的量浓度为。
Cu2O制备Cu2O。将反应后的均匀固体混合物(含有三种成分)等分为两份,一份与足量H2充分反应后,固体质量减少6.4g;另一份恰好溶于500mL稀硝酸,生成标准状况下4.48LNO,该稀硝酸的物质的量浓度为。
【答案】
(1)4Cu(OH)2+N2H4 ![]() N2+2Cu2O+6H2O
N2+2Cu2O+6H2O
(2)O2;由左向右;2Cu+2OH--2e-=Cu2O+H2O;H2O;H2
(3)3.2mol/L
【解析】(1)在加热条件下,用液态肼(N2H4)还原新制的Cu(OH)2制备Cu2O,同时放出N2。根据原子守恒、电子守恒可得该反应的化学方程式为4Cu(OH)2+N2H4![]() N2+2Cu2O+6H2O;
N2+2Cu2O+6H2O;
(2)①用氢氧燃料电池为电源,用电解法制备Cu2O,则Cu电极与电源的正极连接,在燃料电池通氧气的极为正极,通入氢气的电极为负极,所以可知气体A为氧气,A的化学式为O2 ;②根据同种电荷相互排斥,异种电荷相互吸引的原则,在原电池内阴离子向负极移动,故燃料电池内OH-的移动方向为从左向右移动;在电解池中阳极是铜被氧化产生Cu+ , 然后与溶液中的OH-结合形成Cu2O,电极反应式为2Cu+ 2OH-- 2e-=Cu2O+H2O;③电解池内发生的总反应式为2Cu+H2O ![]() Cu2O+H2↑,可知从溶液中减少了水的组成,故需要补充的物质是水,化学式是H2O;④电解池阴极得到的氢气可补充燃料电池中,作为燃料消耗的氢气,可见可循环的物质为H2;
Cu2O+H2↑,可知从溶液中减少了水的组成,故需要补充的物质是水,化学式是H2O;④电解池阴极得到的氢气可补充燃料电池中,作为燃料消耗的氢气,可见可循环的物质为H2;
(3) 将Cu2O拆分为Cu、CuO,原混合物看做Cu、CuO的混合物,将一份混合物用足量的氢气还原,得到Cu和水,反应后固体质量减少6.40g为混合物中O元素的质量,O原子的物质的量为n(O)=6.4g÷16g/mol=0.4mol,根据Cu元素守恒可知n(CuO)= n(O)=0.4mol;另一份中加入500mL稀硝酸,固体恰好完全溶解,溶液中溶质为Cu(NO3)2 , 且同时收集到标准状况下NO气体4.48L,NO的物质的量为n(NO)=4.48L÷22.4L/mol=0.2mol,根据电子转移守恒可知在拆分后Cu、CuO的混合物中,2n(Cu)=3n(NO)=3×0.2mol,n (Cu)=0.3mol,由铜元素守恒可知n[Cu(NO3)2]=n(CuO)+n(Cu)=0.4mol+0.3mol=0.7mol,根据氮元素守恒可知n(HNO3)= n(NO)+2 n[Cu(NO3)2] =0.2mol+ 2× 0.7mol=1.6mol,硝酸的浓度为1.6mol÷0.5L=3.2 mol/L。
(1)根据氧化还原反应的规律进行书写化学方程式;
(2)根据原电池原理进行分析即可;
(3)根据守恒法进行计算即可。


科目:高中化学 来源: 题型:
【题目】把NaOH、MgCl2、AlCl3三种固体组成的混合物溶于足量水后,产生1.16g白色沉淀,再向所得悬浊液中逐滴加入1.00mol/L HCl溶液,加入HCl溶液的体积与生成沉淀的关系如图所示。 试回答:

(1)A点的沉淀物的化学式为__________________,B点的沉淀物的化学式为_____________________。
(2)写出A点到B点发生反应的离子方程式_________________________________________________。
(3)原混合物中MgCl2的质量是__________,AlCl3的质量是______________,NaOH的质量是____________。
(4)C点HCl溶液加入量为________________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.非金属元素(稀有气体元素除外)都是主族元素,单质在反应中都只能作氧化剂
B.常温下,1 mol氯气和足量稀NaOH溶液完全反应转移1mol电子
C.在加热条件下,用乙醇除去乙酸乙酯中的乙酸
D.硫酸铜溶液显酸性的原因:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将aLHCl完全溶于水得到VmL盐酸,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为CmolL。下列叙述中错误的是
A. 可利用CCl4和水吸收HCl,且能防倒吸
B. ω=![]() ×100%
×100%
C. c= ![]() mol/L
mol/L
D. 上述溶液中再加入VmL水,所得溶液的质量分数小于0.5ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某工厂的工业废水中含有大量的FeSO4和较多的Fe3+和Cu2+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。实验室模拟该工业流程如图:
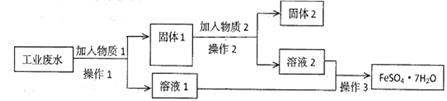
(1)检验废水中的Fe2+,实验室中用酸性KMnO4溶液检验,发生反应的离子方程式为________________________。
(2)加入过量物质1后,发生反应的离子方程式为___________________________。
(3)固体2是_____________________,实验室为长期保存硫酸亚铁溶液往往向其溶液中加入_______________________。
Ⅱ.工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、FeO、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)加入过量的NaOH溶液,过滤后的滤液中含有的溶质有________(填化学式)。
(2)加入过量NaOH溶液过滤后,若滤渣中Fe(OH)2也被氧化,写出其被氧化的化学方程式__________________________。
(3)写出通入过量CO2生成沉淀A时反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废铁屑表面常有铁锈(成分为Fe2O3),并沾有油污。某校研究性学习小组设计实验方案,按以下①~④步骤用废铁屑制备绿矾(FeSO4·7H2O)晶体。
废铁屑 ![]() 铁屑
铁屑![]() 溶液(留有少量铁屑)
溶液(留有少量铁屑)![]() 滤液
滤液 ![]() 绿矾晶体
绿矾晶体
根据该实验方案,回答下列问题:
(1)步骤①中废铁屑与NaOH溶液共热的目的是。
(2)步骤②中烧杯底部留有少量铁屑的理由是。
说明剩余铁屑作用的离子方程式为。
(3)在步骤③中,该小组采用如图抽气过滤(减压过滤)装置代替普通漏斗,其目的是;。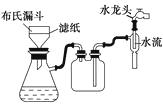
(4)检查步骤③的滤液中没有Fe3+的方法是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法错误的是( ) 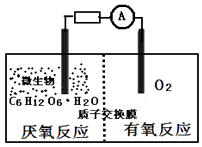
A.负极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从正极区移向负极区
D.电池总反应为C6H12O6+6O2═6CO2+6H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com