
【题目】关于水解应用的说法,错误的是
A.草木灰(主要含K2CO3)与铵态氮肥最好不混用
B.明矾用于净水
C.向CuCl2溶液中加入Cu(OH)2,调节pH可除去溶液中混有的少量Fe3+
D.将AlCl3、Al2(SO4)3溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体成分相同
【答案】D
【解析】
A.草木灰中![]() 和铵态氮肥中
和铵态氮肥中![]() 会发生相互促进的双水解反应生成不稳定的NH3H2O降低肥效,故A不符合题意;
会发生相互促进的双水解反应生成不稳定的NH3H2O降低肥效,故A不符合题意;
B.明矾中Al3+会发生水解生成Al(OH)3胶体,Al(OH)3胶体能够吸附水中的悬浮颗粒达到净水,故B不符合题意;
C.向CuCl2溶液中加入Cu(OH)2,调节pH,可促进Fe3++3H2OFe(OH)3+3H+正向进行,Cu2+几乎不发生沉淀,可除去溶液中混有的Fe3+,故C不符合题意;
D.由于盐酸易挥发,硫酸难挥发,所以将AlCl3、Al2(SO4)3溶液分别加热、蒸发、浓缩、结晶、灼烧,所得固体成分不相同,分别是氧化铝和硫酸铝,故D符合题意;
故答案为:D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】美托洛尔是一种能降低血压,治疗心律不齐的药物,其一种合成路线如图所示:
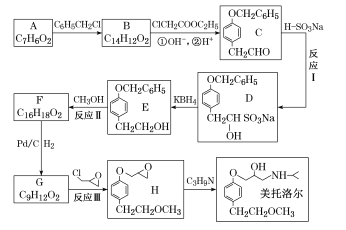
回答下列问题:
(I)A官能团的名称是____,B的结构简式为___________。
(2)反应I的反应类型是____,反应Ⅱ的反应条件是__________。
(3)反应Ⅲ的化学方程式为__________。
(4)化合物H的芳香族类同分异构体K,其性质如下:
①能发生水解反应
②核磁共振氢谱有4组峰.峰面积之比为9:3:2:2
写出一种符合要求的K的结构简式:_________________。
(5)已知:
设计由对氯苯甲醛![]() 为原料制备
为原料制备![]() 的合成路线____。(无机试剂和反应条件所需有机试剂任选,标清反应条件)
的合成路线____。(无机试剂和反应条件所需有机试剂任选,标清反应条件)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①2C(s)+O2(g)=2CO(g) ΔH=-221.0 kJ·mol-1
②2H2(g)+O2(g) =2H2O(g) ΔH=-483.6 kJ·mol-1
则制备水煤气的反应C(s)+H2O(g) =CO(g)+H2(g) ΔH为( )
A.+262.6 kJ·mol-1B.-131.3 kJ·mol-1
C.-352.3 kJ·mol-1D.+131.3 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )
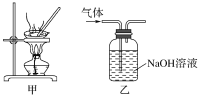
A.为测定新制氯水的pH,用玻璃棒蘸取液体滴在pH试纸上,与标准比色卡对照即可
B.将4.0 g NaOH固体置于100 mL容量瓶中,加水至刻度,配制1.000 molL-1 NaOH溶液
C.用装置甲蒸干AlCl3溶液制无水AlCl3固体
D.用装置乙除去实验室所制乙烯中的少量SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮、硫等元素化合物的性质或转化对建设生态文明、美丽中国具有重要意义。
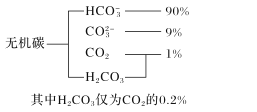
(1)海水中无机碳的存在形式及分布如图所示,用离子方程式表示海水呈弱碱性的主要原因______________________。已知春季海水pH=8.1,预测冬季海水碱性将会_______(填“增强”或“减弱”),理由是_________________。
(2)工业上以CO和H2为原料合成甲醇的反应:CO(g)+2H2(g)===CH3OH(g) ΔH<0,在容积为1L的恒容容器中,分别在T1、T2、T3三种温度下合成甲醇。如图是上述三种温度下不同H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。下列说法正确的是________(填字母)。
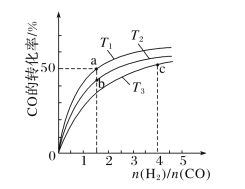
A.a、b、c三点H2转化率:c>a>b
B.上述三种温度之间关系为T1>T2>T3
C.c点状态下再通入1molCO和4molH2,新平衡中H2的体积分数增大
D.a点状态下再通入0.5molCO和0.5molCH3OH,平衡不移动
(3)NO加速臭氧层被破坏,其反应过程如下图所示:
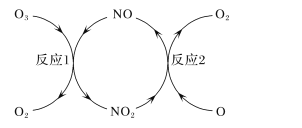
①NO的作用是_________________。
②已知:O3(g)+O(g)===2O2(g) ΔH=-143kJ·mol-1
反应1:O3(g)+NO(g)===NO2(g)+O2(g) ΔH1=-200.2kJ·mol-1 。
反应2:热化学方程式为____________________________。
(4)若将CO和NO按不同比例投入一密闭容器中发生反应:2CO(g)+2NO(g)=N2(g)+2CO2(g) ΔH=-759.8kJ·mol -1,反应达到平衡时,N的体积分数随n(CO)n(NO)的变化曲线如下图。
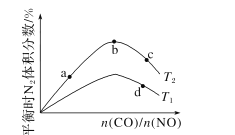
①b点时,平衡体系中C、N原子个数之比接近________。
②a、b、c三点CO的转化率从小到大的顺序为________;b、c、d三点的平衡常数从大到小的顺序为__________。
③若n(CO)n(NO)=0.8,反应达平衡时,N的体积分数为20%,则NO的转化率为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温常压下,将NH3缓慢通入饱和食盐水中至饱和,然后向所得溶液中缓慢通入CO2,整个实验进程中溶液的pH随通入气体体积的变化曲线如图所示(实验中不考虑氨水的挥发)。下列叙述不正确的是
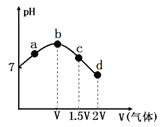
A.由a点到b点的过程中,溶液中 增大
增大
B.由图可知(NH4)2CO3溶液显碱性、NH4Cl溶液显酸性
C.c点所示溶液中,c(NH4+)>c(CO32-)>c(OH-)>c(H+)
D.d点所示溶液中,c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.亚硫酸钠的氧化反应:2Na2SO3 (aq) +O2(aq)=2Na2SO4(aq) H=x kJ/mol。其反应速率受溶解氧浓度影响,分为富氧区和贫氧区两个阶段。
(1)已知O2(g) ![]() O2(aq) H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
O2(aq) H=y kJ/mol,Na2SO3 溶液与O2(g)反应的热化学方程式为___________________。
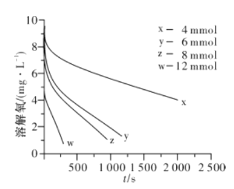
(2)291.5 K时,1.0 L溶液中Na2SO3初始量分别为4、6、8、12 mmol,溶解氧浓度初始值为9.60 mg/L,每5 s记录溶解氧浓度,实验结果如图所示。当Na2SO3初始量为12 mmol,经过20 s溶解氧浓度降为6.40 mg/L,则0~20s内Na2SO3的平均反应速率为_______mol/(L·s)。
(3)为确定贫氧区速率方程v=k·ca(SO32-)·cb(O2)中的a、b的值(取整数),分析实验数据。
c(Na2SO3)×103 | 3.65 | 5.65 | 7.65 | 11.65 |
v×106 | 10.2 | 24.4 | 44.7 | 103.6 |
①当溶解氧浓度为4.0 mg/L时,c(SO32-)与速率数值关系如表(甲)所示,则a=____。
②当溶解氧浓度小于4.0mg/L时,图中曲线皆为直线,Na2SO3氧化速率与溶解氧浓度无关,则b=_______。
(4)两个阶段不同温度的速率常数之比如表(乙)所示。已知![]() ,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
,R为常数。Ea(富氧区)_____ (填“>”或“<”)Ea(贫氧区)。
反应阶段 | 速率方程 |
|
富氧区 | v=k·c (SO32-)·c (O2) | 1.47 |
贫氧区 | v=k·ca (SO32-)·cb(O2) | 2.59 |
II. (5)在容积固定的密闭容器中,起始充入0.2 mol SO2和0.1 mol O2,反应体系起始总压强0.1MPa。反应在一定温度下达到平衡时SO2的转化率为90%。该反应的压强平衡常数Kp=________ ( 分压=总压×物质的量分数)(写单位)。
(6)利用原电池原理,也可用SO2和O2来制备硫酸,该电池用多孔材料作电极。请写出该电池负极反应式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学实验操作,现象和结论均为正确的是
选项 | 操作 | 现象 | 结论 |
A | Mg2+和Cu2+共存的溶液中滴入适量NaOH溶液 | 产生白色沉淀 | 相同温度下,溶度积常数 Ksp[Mg(OH)2]<Ksp[Cu(OH)2] |
B | 加热盛有(NH4)2CO3固体的试管,并在试管口放置湿润的红色石蕊试纸 | 试纸变蓝 | (NH4)2CO3显碱性 |
C | 常温下,向等浓度、等体积的Na2CO3和NaHCO3溶液中滴加等量的酚酞溶液 | 碳酸钠溶液中红色更深 | 阴离子水解常数Kh: CO32->HCO3- |
D | 向饱和硼酸溶液中滴加少量Na2CO3粉末 | 无气泡冒出 | 不能证明酸性:碳酸>硼酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是( )

A.分子中含有4种含氧官能团
B.分枝酸一定条件下可以发生缩聚反应们不能发生加聚反应
C.1mol分枝酸最多可与2molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com