
| 716.8L |
| 22.4L/mol |


科目:高中化学 来源: 题型:
| A、氯气可用于漂白,是因为氯气有强氧化性 |
| B、工业用石灰石、纯碱和石英在高温下制得玻璃的原理与硅酸和碳酸的酸性强弱有关 |
| C、神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材 |
| D、硫酸工业中,从吸收塔上部导出的气体再次通入接触室进行二次氧化,进一步吸收后,二氧化硫的含量很少,可直接排放到空气中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用灼烧并闻气味的方法区别纯棉织物和纯羊毛织物 |
| B、用食醋、石灰水验证蛋壳中含有碳酸盐 |
| C、用米汤检验食用加碘盐(含KIO3)中含有碘 |
| D、用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当金属全部溶解时收集到NO气体的体积为3.36L |
| B、当金属全部溶解时,无法计算参加反应的硝酸的物质的量 |
| C、将生成的沉淀加热灼烧,可能得到FeO、Fe2O3和CuO的混合物 |
| D、当生成沉淀达到最大量时,消耗NaOH溶液的体积为V≥75ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:1:2 |
| B、2:3:1 |
| C、1:4:1 |
| D、5:3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
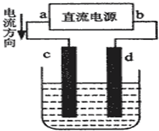 如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )
如图是电解CuCl2溶液的装置,其中c、d为石墨电极.则下列有关的判断正确的是( )| A、a为负极、b为正极 |
| B、电解过程中,c电极发生还原反应 |
| C、电解过程中,d电极质量增加 |
| D、电解过程中,氯离子浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 现有一定质量的某种碱金属的两种碳酸盐(正盐和酸式盐)组成的混合物加水溶解后向其中所得溶液逐滴加入一定浓度的稀盐酸,并同时记录放出二氧化碳气体的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线.下列说法不正确的是( )
现有一定质量的某种碱金属的两种碳酸盐(正盐和酸式盐)组成的混合物加水溶解后向其中所得溶液逐滴加入一定浓度的稀盐酸,并同时记录放出二氧化碳气体的体积(标准状况)和消耗盐酸的体积,得到如图所示的曲线.下列说法不正确的是( )| A、由图可知正盐和酸式盐的物质的量之比为3:2 |
| B、由图可知含正盐物质的量为0.003mol |
| C、盐酸的浓度为0.25mol/L |
| D、两种盐的总物质的量为0.05mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg和Fe |
| B、Fe和Zn |
| C、Mg和Al |
| D、Al和Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
| [H2][CO] |
| [H2O] |
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com