
【题目】[化学——选修3:物质结构与性质]X、Y、Z、W是前四周期中常见的四种元素。X的基态原子核外电子共占据5个原子轨道,其中能量最高的能级上的电子有3种运动状态;Y能形成最强的无机含氧酸,Z的单质是前36号元素中最活泼的金属单质,W的一种核素的质量数是56,中子数是30。
(1)W的稳定价态离子的核外电子排布式为_________,Y、Z、W电负性由大到小的顺序为___________(填元素符号)。
(2)X与同周期相邻的另外两种元素相比其第一电离能最大,原因是_____________________X和与X同族的另外两种前四周期元素的简单氢化物的沸点由低到高的顺序为_______________,试解释其原因__________________
(3)XY3的中心原子轨道杂化类型为_________
(4)已知WY3的沸点为319 ℃,熔点为306 ℃,则WY3的晶体类型为____________Z的重要化合物Z2O2中存在的化学键类型有_______________
A.离子键 B.极性共价键 C.非极性共价键 D.π 键
(5)若Z的晶胞为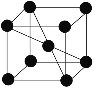 ,Z离子的半径为d cm,则Z单质的密度为_______。
,Z离子的半径为d cm,则Z单质的密度为_______。
【答案】(1)1s22s22p63s23p63d5或[Ar]3d5 Cl>Fe>K
(2)碳元素的非金属性比氮的弱,第一电离能最小,氮元素因其2p能级处于半充满状态,故其第一电离能比氧元素的大 PH3<AsH3<NH3 NH3能形成分子间氢键导致沸点升高,PH3、AsH3均不能形成分子间氢键,又PH3的相对分子质量较AsH3小,其分子间作用力较小,沸点较低(其他合理说法也对)
(3)sp3(1分)(4)分子晶体(1分)ac(1分)(5)![]() g·cm-3
g·cm-3
【解析】
试题分析:X、Y、Z、W是前四周期中常见的四种元素。X的基态原子核外电子共占据5个原子轨道,其中能量最高的能级上的电子有3种运动状态,则X的电子排布式为1s22s22p3,即X是N;Y能形成最强的无机含氧酸,所以Y是Cl;Z的单质是前36号元素中最活泼的金属单质,则Z是K;W的一种核素的质量数是56,中子数是30,则质子数=56-30=26,即为Fe。
(1)铁的稳定价态离子是铁离子,其核外电子排布式为1s22s22p63s23p63d5或[Ar]3d5;非金属性越强,电负性越大,则Y、Z、W电负性由大到小的顺序为Cl>Fe>K。
(2)碳元素的非金属性比氮的弱,第一电离能最小,氮元素因其2p能级处于半充满状态,故其第一电离能比氧元素的大;由于NH3能形成分子间氢键导致沸点升高,PH3、AsH3均不能形成分子间氢键,又PH3的相对分子质量较AsH3小,其分子间作用力较小,沸点较低,因此简单氢化物的沸点由低到高的顺序为PH3<AsH3<NH3。
(3)NCl3的中心原子N原子的价层电子对数=![]() ,所以轨道杂化类型为sp3。
,所以轨道杂化类型为sp3。
(4)已知FeCl3的沸点为319 ℃,熔点为306 ℃,这说明氯化铁的晶体类型为分子晶体;K的重要化合物K2O2中存在的化学键类型有离子键和非极性键,答案选ac。
(5)根据钾的晶胞可知晶胞中含有8×1/8+1=2个钾原子,钾离子的半径为dcm,则晶胞的边长是![]() ,所以Z单质的密度为
,所以Z单质的密度为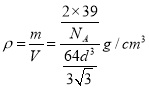 =
=![]() g·cm-3。
g·cm-3。


科目:高中化学 来源: 题型:
【题目】关于二氧化硅,下列叙述不正确的是( )
A.水晶的主要成分是二氧化硅
B.二氧化硅和二氧化碳在物理性质上有很大差别
C.二氧化硅不溶于水,也不能跟水起反应生成酸
D.二氧化硅是一种酸性氧化物,它不跟任何酸起反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将10.8g的Ag投入一定量的浓硝酸中完全溶解得到NO和NO2的混合气体,用NaOH溶液把该混合气体完全吸收得釗NaNO3和NaNO2的混合溶液,则所得NaNO2的物质的量为
A. 0.05mol B. 0.06mol C. 0.075mol D. 0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,△H1=-393.5kJ.mol-1, △H2=-395.4kJ.mol-1,下列正确的是

A. C(s、石墨)="=" C(s、金刚石) △H=" +1.9" kJ·mol -1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】指出下列反应中SiO2所表现的化学性质或作用,在A~E选项中选择正确答案填入括号内。
①SiO2+2NaOH===Na2SiO3+H2O
②SiO2+2C===Si+2CO↑
③SiO2+3C===SiC+2CO↑
④SiO2+4HF===SiF4↑+2H2O
a.作为玻璃的成分被消耗而使玻璃被腐蚀
b.氧化性
c.酸性氧化物的通性
d.未参加氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示。下列说法正确的是( )
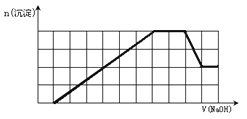
A. 原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+
B. 原溶液中一定含有SO42-和Na+
C. 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D. 反应最后形成的溶液中含有的溶质为Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属的叙述中正确的是( )
A.所有的金属都是固态的
B.金属具有导电性、导热性和延展性
C.金属元素在自然界中都是以化合态存在的
D.活泼的金属或较活泼的金属能与酸反应,但不能与碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
A. 常温常压下,用铁和浓硫酸制取SO2气体
B. 用酸性高锰酸钾溶液鉴别环己烷和甲苯
C. 用饱和碳酸氢钠溶液除去O2中混有的少量HCl气体
D. 用分液漏斗分离苯和四氯化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com