
已知:P4(g)+6Cl2(g)=4PCl3(g) △H=a kJ∙mol—1
P4(g)+10Cl2(g)=4PCl5(g) △H=b kJ∙mol—1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ∙mol—1,PCl3中P-Cl键的键能为1.2c kJ∙mol—1。
下列叙述正确的是
A.P-P键的键能大于P-Cl键的键能
B.可求Cl2(g)+ PCl3(g)=4PCl5(g)的反应热△H
C.Cl-Cl键的键能为(b-a+5.6c)/4 kJ∙mol—1
D.P-P键的键能为(5a-3b+12c)/8 kJ∙mol—1
科目:高中化学 来源: 题型:
以下关于化学实 验中“先与后”的说法中正确的是( )
验中“先与后”的说法中正确的是( )
①加热试管时,先均匀加热,后局部加热;
②用排水法收集气体时,先移出导管后撤酒精灯;
③制取物质时,先检查装置气密性后装药品;
④使用容量瓶、分液漏斗、滴定管前, 先检查是否漏水后洗涤干净;
先检查是否漏水后洗涤干净;
⑤做H2还原CuO实验时,先加热CuO后通H2;反应完毕后,先撤酒精灯待试管冷却后停止通H2。
A.除②以外 B.除④以外 C.除⑤以外 D.全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:

(1)外电路的电流方向是由________极流向________极。(填字母)
(2)电池正极反应式为__________________________。
(3)是否可用水代替电池中的混合有机溶剂?________(填“是”或“否”),原因是________________________________________________。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为____________________________________。K2MnO4在酸性溶液中歧化,生成KMnO2和MnO2的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式错误的是( )
A.向Ba(OH)2溶液中滴加稀硫酸:
Ba2++2OH-+2H++SO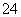 ===BaSO4↓+2H2O
===BaSO4↓+2H2O
B.酸性介质中KMnO4氧化H2O2:
2MnO +5H2O2+6H+===2Mn2++5O2↑+8H2O
+5H2O2+6H+===2Mn2++5O2↑+8H2O
C.等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-===Mg(OH)2↓
D.铅酸蓄电池充电时的正极反应:PbSO4+2H2O-2e-===PbO2+4H++SO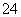
查看答案和解析>>
科目:高中化学 来源: 题型:
以石墨为电极,电解KI溶液(其中含有少量酚酞和淀粉)。下列说法错误的是( )
A.阴极附近溶液呈红色
B.阴极逸出气体
C.阳极附近溶液呈蓝色
D.溶液的pH变小
查看答案和解析>>
科目:高中化学 来源: 题型:
二甲醚(CH3OCH3)是无色气体,可作为一种新型能源,由合成气(组成为H2、CO、和少量CO2)直接制备二甲醚,其中主要过程包括以下四个反应:
甲醇合成反应:
①CO(g)+ 2H2(g)=CH3OH(g) △H1=-90.1 kJ·mol-1
②CO2(g)+ 3H2(g)=CH3OH(g)+H2O(g) △H2=-49.0 kJ·mol-1
水煤气变换反应:
③CO(g) + H2O (g)=CO2(g)+H2(g) △H3=-41.1 kJ·mol-1
二甲醚合成反应:
④2CH 3OH(g)=CH3OCH3(g)+H2O(g) △H4=-24.5 kJ·mol-1
3OH(g)=CH3OCH3(g)+H2O(g) △H4=-24.5 kJ·mol-1
⑴Al2O3是合成气直接制备二甲醚反应催化剂的主要成分之一。工业上从铝土矿制备较高纯度Al2O3的主要工艺流程是 (以化学方程式表示) 。
⑵分析二 甲醚合成反应④对于CO转化率的影响 。
甲醚合成反应④对于CO转化率的影响 。
⑶由H2和CO直接制备二甲醚(另一产物为水蒸气)的热化学方程式为 。
⑷有研究者在催化剂(含Cu-Zn-Al-O和Al2O3),压强为5.0MPa的条件下由H2和CO直接制备二甲醚,结果如下图所示。其中CO转化率随温度升高而降低的原因是____________。
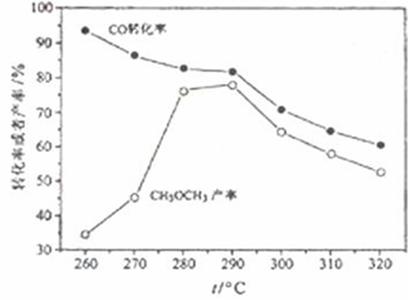
⑸二甲醚直接燃料电池具有启动快,效率高等优点,其能量密度高于甲醇直接燃烧燃料电池(5.93kW·h·kg-1),若电解质为酸性,二甲醚直接燃料电池的负极反应为_______________。
一个二甲醚分子经过电化学氧化,可以产生_______个电子的电量;该电池理论输出电压1.20V,能量密度E=_____(列式计算,能量密度=电池输出电能/燃料质量,1kW·h=3.6×105J )
查看答案和解析>>
科目:高中化学 来源: 题型:
氢氟酸是一种弱酸,可用来刻蚀玻璃。已知25℃时
①HF(aq)+OH—(aq)=F—(aq)+H2O(l) △H=—67.7KJ·mol—1
②H+(aq)+OH—(aq)=H2O(l) △H=—57.3KJ·mol—1
在20mL0.1·molL—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,下列有关说法正确的是
A.氢氟酸的电离方程式及热效应可表示为:
HF(aq)=H+(aq) +F−(aq) △H=+10.4KJ·mol—1
B.当V=20时,溶液中:c(OH—)=c(HF) +c(H+)
C.当V=20时,溶液中:c(F—)<c(Na+)=0.1mol·L—1
D.当V >0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
>0时,溶液中一定存在:c(Na+)>c(F—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各表述与示意图一致的是
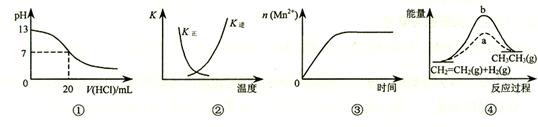
A.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
B.图②中曲线表示反应2SO2(g) + O2(g)  2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
2SO3(g);ΔH < 0 正、逆反应的平衡常数K随温度的变化
C.图③表示10 mL 0.01 mol·L-1 KMnO4 酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化
D.图④中a、b曲线分别表示反应CH2=CH2 (g) + H2(g) CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
CH3CH3(g);ΔH< 0使用和未使用催化剂时,反应过程中的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
如图中,A、B、C、D、E是单质,G、H、I、F是B、
C、D、E分别和A形成的二元化合物,已知:
①反应C+G  B+H能放出大量的热,
B+H能放出大量的热,
G是红综色固体粉末;
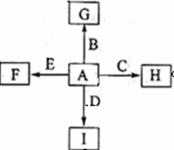
②I是一种常见的温室气体,它和E可以发生反应:
2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
⑴ ①中反应的化学方程式为
(2) 1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉 克
(3) C与过量NaOH溶液反应的离子方程式为 ,
反应后的溶液与过量的化合物I反应的离子方程式为
(4) E与I反应的化学方程式为
(5) 写出H物质在工业上的一种用途_____________。
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为( )
A.0.01mol B.0.03mol C.0.04mol D.0.07mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com